【摘要】 复旦大学刘智攀、华南师大赵纪军教授力荐!深度解读《模拟计算指南》共价键强度分析方法:电子密度差分、键级/ELF判据、键能定义局限,附氯仿/NHC-Ag配合物/氢键复合物实战案例。扫码获取计算化学权威指南。

关于本书
《模拟计算指南》是唯理计算工程师团队沉淀7年实战经验、历时一年打造,是一本计算化学快速入门指南、材料模拟计算领域的实用宝典。
“书中详细介绍了从理论计算化学的基本原理到目前国际前沿应用体系的计算模拟思路和方法,有利于读者从多维度理解如何采用理论计算方法来解决复杂科学问题,并帮助初学者从中找到适合自己科研的理论支持和计算解决方案。”
——教育部长江学者、杰青、复旦大学教授
刘智攀
“本书以其实用性和易学性为特色,无论是计算物质科学的初学者还是资深研究者,都能从中获得独特的视角和丰富的知识资源,使其成为该领域内一本极具价值的入门及参考书籍。”
——教育部长江学者特聘教授、华南师范大学教授
赵纪军

↑扫码了解更多书籍及唯理计算信息
01文章介绍
今天我们介绍下《模拟计算指南》的3.5.2共价键强度。
为了凸显电子密度分布中蕴含的感兴趣的细节,可以对电子密度进行做差,以考察两个 片段结合前后电子密度是如何变化的。此时,对于共价键,就可以明显观察到成键区域的电子积累。类似的方法也可以用于探讨化学键的强度。
(1)对于若干同类化学键,可以通过对比键长推断彼此的强度。必须注意的是,这种比 较的前提是参与成键的原子种类相同;当原子种类不同时,原子半径将成为键长的决定性因素 。P—O键比F—F键长很多,据此就说前者比后者弱显然是荒谬的。
(2)类似地,对于同类化学键,键级和 ELF也可以用于比较成键的强度。其中,键级是针对特定化学键的固定数值,而 ELF是实空间函数,想用ELF判断成键强度需要面临“采取什么位置的ELF”的问题。对此,最简单的方法是使用键临界点(bond critical point, BCP)处的数值。
键临界点是拓扑分析的核心概念。拓扑分析又叫AIM(atom in molecules)分析,在这一过程中,试图找到一系列反映分子成键特性的关键位置,其中包括键临界点、环临界点等,键临界点通常是人们最关心的。需要注意的是,虽然键临界点的名字似乎代表了它跟化学键强相关,但事实上并非所有的化学键都存在键临界点,也不是存在键临界点就必然有化学键,而是需要结合键临界点处的ELF、电子密度等数值进行分析。拓扑分析的详细内容比较复杂,简单来说,虽然存在不少例外,但在多数情况下,可以认为键临界点处的 ELF和电子密度的数值能够反映共价键的强度;对于同类共价键,其数值越大,往往对应成键越强。
(3)比较键能。键能是历史最悠久的用于衡量化学键强度的手段,其定义为化学键均裂 生成两个自由基的能量变化。根据测定方法不同,可能意味着焓变、零点能变化等,多数情况下默认为焓变。
由于研究化学键强度的目的往往是用于解释和预测化学反应的能量变化,键能是最直 接有效的探究化学键强度的手段。不幸的是,在相当多情况下,键能是无法定义的。试想苯分子:如果要定义C—H键能,则只需考察其断裂生成的苯基自由基和氢原子的能量;而如果要考察C—C键能,该如何定义?由于并不存在相应的“化学键断裂产物”,苯分子中C—C键的强度是无法用键能衡量的(图3.14)。这种情况下,前述其他方法就更具价值。
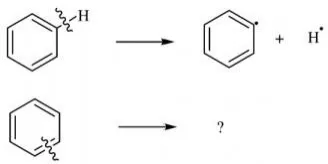
图3.14 苯中C-H与C-C键能的定义
之后两期将分别举例展示上述提到的性质。
02实战示例
1.氯仿
氯仿的电子结构非常经典而明确(图3.15)。在M06-2X/TZVP水平下,得到 C—H和C—Cl的 Mayer键级分别为0.93和1.14,对应典型的共价单键。
2.NHC-Ag配合物
在NHC-Ag配合物中(图3.16),显然C—Ag存在共价成键,而其 Mayer键级为0.73。可见共价键的键级是连续的,只要存在显著的数量,就可以认为存在成键。在后续的章节中,我们会借助更多手段进一步分析其中C—Ag键的本质。
该分子中环上C—N键级为1.27,C—C 键级为1.60,显然共轭导致键级发生了平均化。
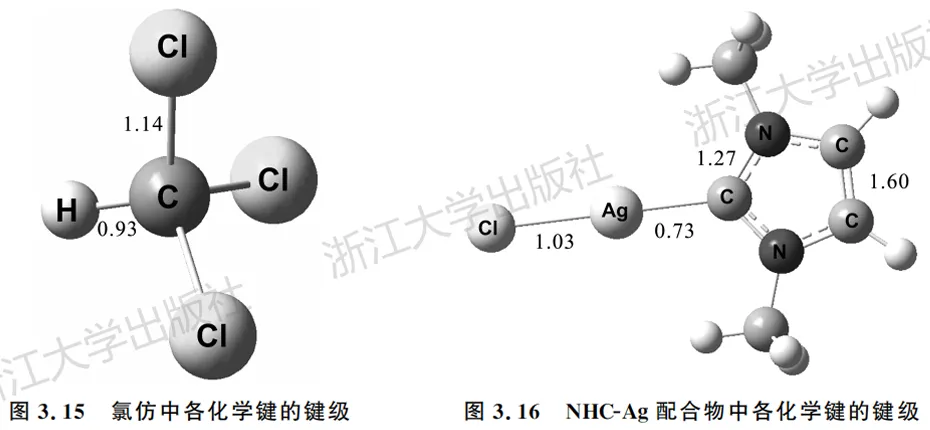
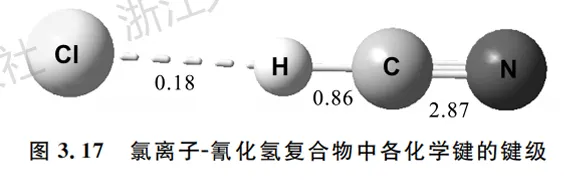
3.氰化氢和氯离子形成的氢键复合物
在见过几个有明显成键的例子之后,再与氢键复合物(图3.17)对比,对于键级的含义将有更深的感受。显然此处Cl与H不存在共价键,两者的Mayer键级为0.18,较小的键级提示非共价作用的存在。

多位专家力荐 超全实战指南












 您已经拒绝加入团体
您已经拒绝加入团体

 2025-06-04
2025-06-04
 2686
2686
 0
0










