【摘要】 质谱仪种类很多,不同类型的质谱仪主要差别在于离子源。离子源的不同决定了对被测样品的不同要求,同时,所得信息也不同。质谱仪的分辨率同样十分重要,高分辨质谱仪可给出化合物的组成式,对于未知物定性至关重要。因此,在进行质谱测试分析前,要根据样品状况和分析要求选择合适的质谱仪。
质谱仪种类很多,不同类型的质谱仪主要差别在于离子源。离子源的不同决定了对被测样品的不同要求,同时,所得信息也不同。质谱仪的分辨率同样十分重要,高分辨质谱仪可给出化合物的组成式,对于未知物定性至关重要。因此,在进行质谱测试分析前,要根据样品状况和分析要求选择合适的质谱仪。
目前,有机质谱仪主要有两大类:气相色谱-质谱联用仪与液相色谱-质谱联用仪。今天小编主要从以下三个部分给大家科普一下质谱分析方法的基础知识:
一. 质谱基础及相关术语
二. 定性(确证)方法
三. 定量方法
质谱基础及相关术语
基础
1. 质谱仪的基本结构
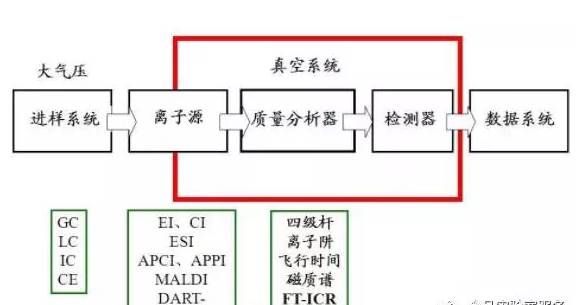
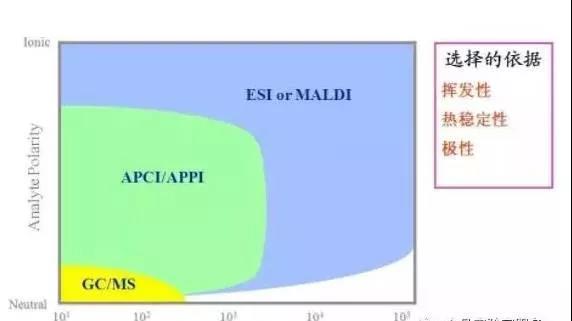
2.各种离子化方法的使用范围
3.质谱仪的主要性能指标

相关术语
质谱峰类型
♫ 分子离子
• 必须是化合物谱图中质量最高的离子
• 必须是奇电子离子、符合氮规则
• 必须能通过丢失合理的中性离子,产生谱图中高质量区的重要离子
♫ 准分子离子
♫ 碎片离子
♫ 同位素离子
• 由于天然同位素的存在,因此在质谱图上出现M+1,M+2等峰,由这些同位素所形成的峰称之为同位素峰。
定性(确证)方法
基本原则
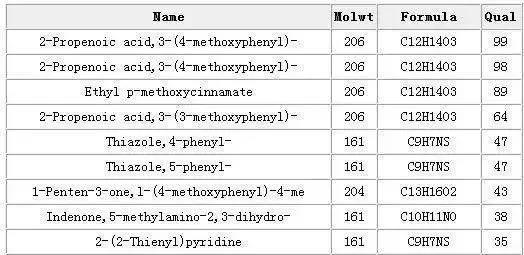
目前,色质联用仪数据库中,一般贮存有近30万个化合物标准质谱图。因此,GC-MS最主要的定性方式是库检索。由总离子色谱图可以得到任一组分的质谱图,由质谱图可以利用计算机在数据库中检索。检索结果,可以给出几种最可能的化合物。
包括:化合物名称、分子式、分子量、基峰及可靠程度。下表是由计算机给出的某未知物谱图检索结果。
在分析仪器上的进样顺序是:空白溶剂、阴性控制样品、要确证的样品、阳性控制样品再进样,最后是阴性控制样品。
色谱分离
1. 保留时间
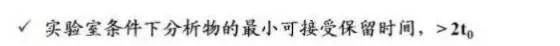
气相色谱(GC)或液相色谱(LC)时,半峰宽应在原来峰宽的90-110%以内,保留时间的变化应在5%以内。
测试部分中分析物的保留时间(或相对保留时间),应在一个特定的保留时间窗口范围内与校正标准的保留时间相符。保留时间窗口与该色谱系统的分辨能力相当。分析物和内标的保留时间之比,应与校正溶液的相对保留时间一致,GC偏差为±0.5%,LC偏差为±2.5%。
3. 质谱检测
(1)全扫描scan
全扫描是对指定质量范围内的离子全部扫描并记录,得到的是正常的质谱图,这种质谱图可以提供未知物的分子量和结构信息。可以进行库检索。
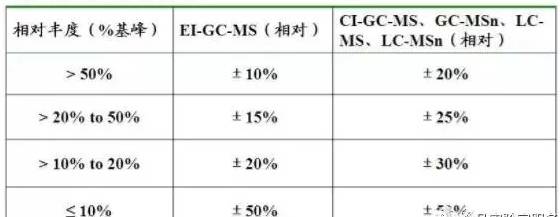
用记录全扫描质谱图进行质谱测定时,在标准品参考图谱中所有相对丰度>10%(分子离子、分子离子的特征加成物、特征碎片离子、同位素离子等)的特征离子都必须检测。
(2)选择离子监测SIM
质谱仪还有另外一种扫描方式叫选择离子监测(Selection Moniring SIM)。此种扫描方式是只针对选定的离子进行检测,而其它离子不被记录。
用碎片离子色谱图进行质谱测定时,分子离子最好是一个选择的检测离子。选择的检测离子并不一定要源于分子的同一部分,每个检测离子的信噪比应≥3:1。
☞ 相对离子丰度最大容许误差
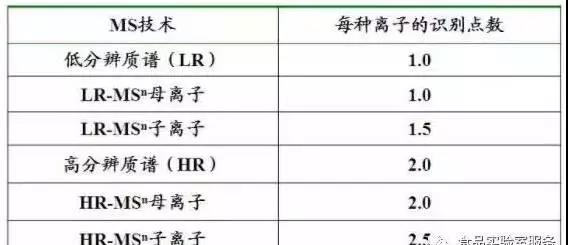
☞ 质量碎片类型和识别点的关系
√ 每个离子计算一次;
√ EI-GC-MS、CI-GC-MS作为不同的技术计算;
√ 用不同反应得到的衍生物,可增加识别点数;
√ 包括:二级离子和多级离子;
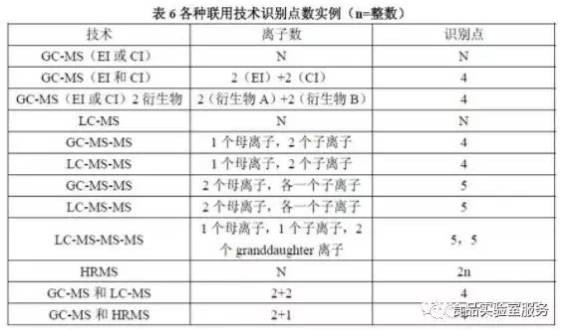
√ 可最多结合三种不同的技术确定最小识别点数。
☞ 各种联用技术识别点数实例
定量方法
外标法
方法
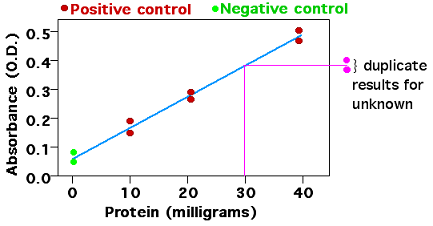
将待测物质A的标准品(特点是纯度非常高,有时也可称之为该物质的纯品)用某种有机溶剂S稀释成不同的浓度的标准溶液,分别取等量(一般是等体积)的这些不同浓度的标准溶液进行质谱分析。由此可以得到一组样品量和信号值一一对应的数据,以其绘制成的曲线称为标准曲线。现在就有了一把还不错的尺子,然后就可以去拿要检测的实际样品R进行质谱分析了。根据标准曲线就可以由得到的信号值去反推物质A在该实际样品R中的含量了。
内标法
外标法主要有以下两方面的局限:1、标样和待测样是独立进行实验的,实验间的偶然误差无法消除;2、标样和待测样的基质(即除待分析物外的其它成分)不同,基质有可能会带来不同的影响,也会产生误差。
那么,如果我们把已知量的标准样品B直接加入待测样品A,就可以把标准样品和未知样品的测定在同一次实验和同样基质中完成,也就消除了两次实验和基质不同造成的误差,这就是内标法。
1.内标物
基本要求:
(a)试样中不含有该物质;
(b)与被测组分性质比较接近;
(c)不与试样发生化学反应;
(d)出峰位置应位于被测组分附近。
2.计算式

标准加入法
♪ 先测定出未知样品的大概值,然后根据这个测定值去设定标准加入法
♪ 标准加入法中第一点加入标准溶液为“0”,第二点加入的量约与待测组分的含量大致相等,共3~5个点,以加入的标准溶液的浓度为横坐标,峰面积为纵坐标绘制工作曲线
♪ 工作曲线在横坐标延长线上的交点到坐标原点的距离即为样品中待测组分的浓度
♪ 标准加入法可以看作是内标法和外标法的结合
♪ 由于待测组分以及加入的标准溶液处在相同的样品基体中,因此,这种方法可以消除基质干扰
♪ 但是,由于对每一个样品都要配制三个以上的、含样品溶液和标准溶液的混合溶液,因此,这种方法不适于大批样品的分析
基质效应
1.概念
基质效应是指在样品测试过程中,由于待测物以外的其他物质的存在,直接或间接影响待测物响应的现象。
由于质谱检测的高选择性,基质效应的影响在色谱图上往往观察不到,即空白基质色谱图表现为一条直线,但这些共流出组分会改变待测物的离子化效率,引起对待测物检测信号的抑制或提高。
2.产生机制
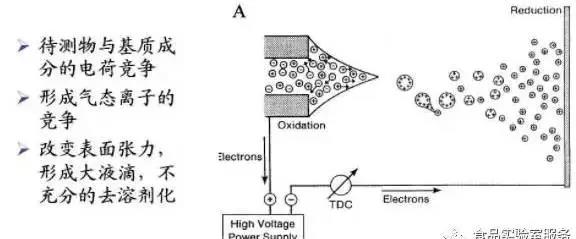
3.来源
内源性:来源于待测样品,如,蛋白、脂质、多糖、目标组分的类似物,其他色谱共流出物;
外源性:流动相组成、样品处理过程中带入、管路、环境。
4.评价
(1)提取后加入法
是一种静态的方法,只能提供基质效应在待测成分出峰位置点上的影响信息,但能以具体的数据体现基质效应对待测成分响应的影响程度;

(2)灌后加入法

来源:食品实验室服务、材料+











 您已经拒绝加入团体
您已经拒绝加入团体

 2021-07-16
2021-07-16
 16604
16604
 0
0










