【摘要】 深度解读蛋白质糖基化机制、N/O-连接聚糖结构差异及糖蛋白组学技术进展。涵盖糖基化在癌症、免疫疾病中的调控作用,为疾病诊断提供新思路。
蛋白质糖基化是生物体内广泛存在的关键修饰机制,通过碳水化合物与多肽链的共价结合,调控蛋白质结构与功能。这一非模板化过程由糖基转移酶和寡糖转移酶协同完成,直接影响细胞通讯、免疫应答及疾病发生。本文系统解析糖基化类型、功能及糖蛋白组学研究进展,为疾病诊断与治疗提供理论支撑。
一、糖基化核心机制与生物学意义
蛋白质糖基化包含N-连接(靶向天冬酰胺)、O-连接(靶向丝氨酸/苏氨酸)和C-连接(靶向色氨酸)三种主要途径(图1a)。其中,N-连接和O-连接聚糖在哺乳动物中研究最为深入,其结构多样性通过"宏观异质性"(糖基化位点有无)和"微异质性"(单糖排列差异)体现。
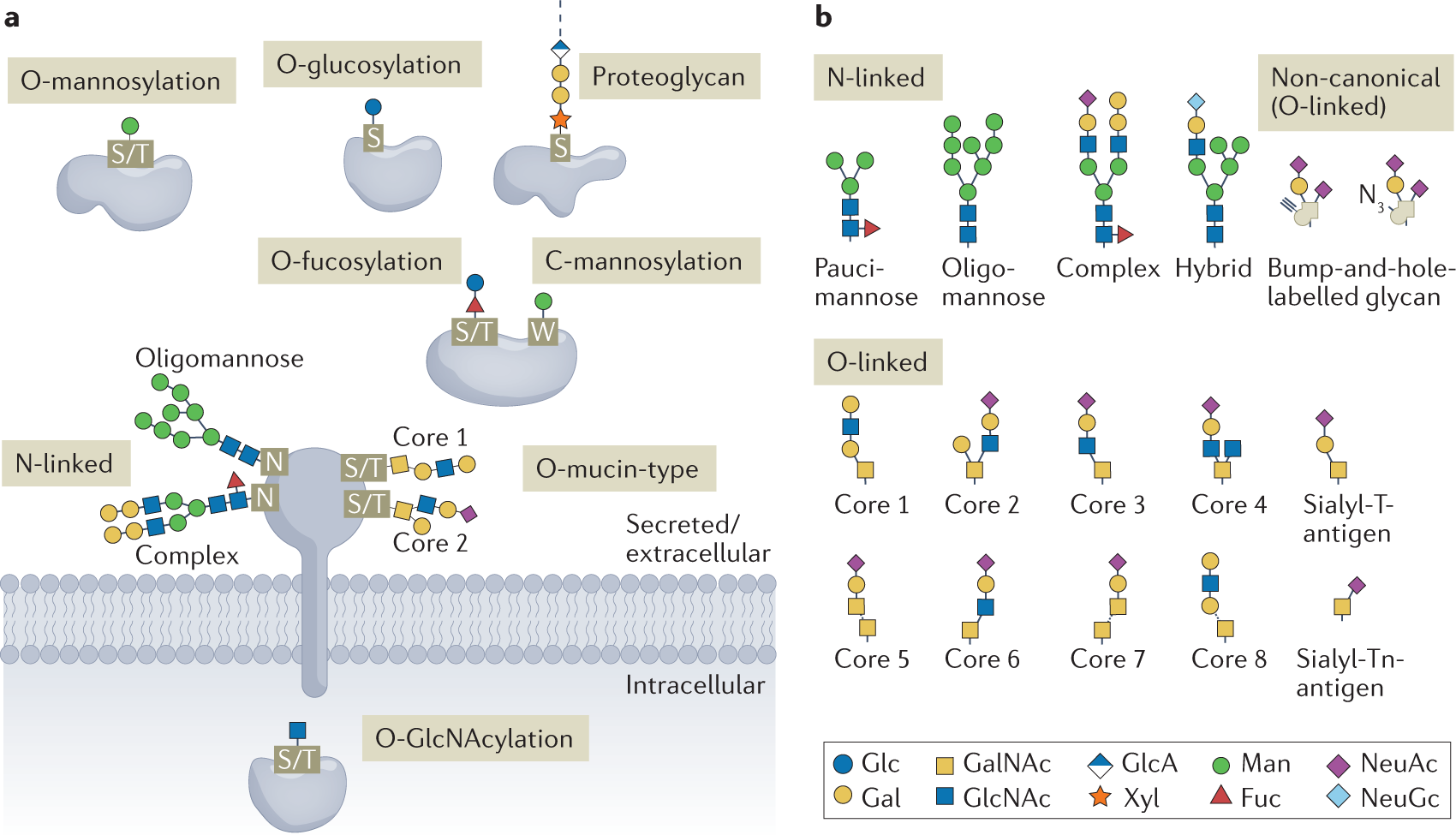
图1: 哺乳动物系统中观察到的蛋白质糖基化类别和常见聚糖
注:糖基化通过调控细胞表面蛋白稳定性,参与白细胞归巢、宿主-病原体互作等关键过程。糖基化异常已被证实与癌症、神经退行性疾病密切相关。
二、聚糖分类与结构特征
1.N-连接聚糖
- 少甘露糖型:含1-3个甘露糖核心
- 寡甘露糖型:末端分支仅含甘露糖
- 复合型/杂合型:含半乳糖、岩藻糖等修饰(图1b)
2.O-连接聚糖
已发现8种核心结构,以GalNAc为连接基点,通过分支差异调控粘蛋白功能。代谢低聚糖工程技术可引入炔烃等化学基团,实现特异性标记。
三、糖蛋白组学研究方法与技术突破
传统糖组学聚焦游离聚糖分析,而完整糖肽分析技术通过液相色谱-串联质谱(LC-MS/MS),在单次实验中实现:
- 糖基化位点精确定位
- 组织/细胞特异性糖型图谱构建
- 疾病标志物筛选(如癌症相关岩藻糖基化)
该技术突破为解析糖基化在生理/病理中的动态调控提供高精度工具。
四、糖基化与疾病关联研究进展
临床研究表明:
1.肿瘤微环境中O-GlcNAc修饰异常驱动转移
2.精神分裂症患者脑脊液N-糖基化谱显著改变
3.岩藻糖基化缺失导致先天性免疫缺陷
基于糖蛋白组学的诊断试剂开发(如血清IgG糖型检测)已进入临床转化阶段。
参考文献:1.Bagdonaite, I., Malaker, S.A., Polasky, D.A. et al. Glycoproteomics. Nat Rev Methods Primers 2, 48 (2022). https://doi.org/10.1038/s43586-022-00128-4.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,提供材料测试、高端测试、环境检测、生物服务、模拟计算、科研绘图、数据分析、试剂耗材、行业解决方案、指南针学院等多项科研产品和服务矩阵。企业致力于为高校、科研院所、医院、研发型企业等科研工作者,提供专业、快捷、全方位的检测及科研服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-05-13
2025-05-13
 4246
4246
 0
0










