【摘要】 现如今,电镜在生物医学研究中的应用越来越频繁,电镜在揭示生物结构与功能的关系上起到重要作用。
现如今,电镜在生物医学研究中的应用越来越频繁,电镜在揭示生物结构与功能的关系上起到重要作用。近年来,电镜技术的普及使其在SCI论文中出场率越来越高。
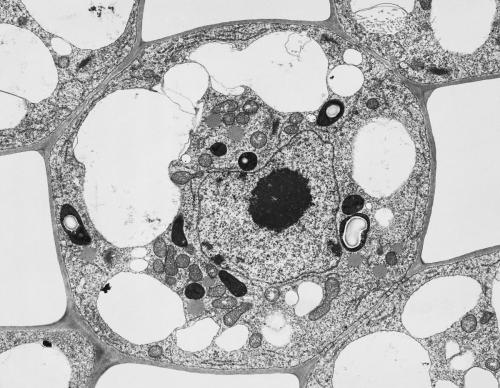
那么,一张漂亮的电镜图该怎么得到呢?
重中之重当然是样本制备了,
今儿,我就针对“电镜样本制备”作一简单的介绍。
1.电镜简介
1665年,Robert Hoek制作出世界上第一台光学显微镜,开启了生物医学研究的微观时代。人眼的分辨率最大为0.2mm(1mm=10^6nm),光学显微镜的分辨率为200nm。

但是后来,人们发现光学显微镜已经不注意帮助我们观察世界了。于是,近300年后的1932年,电镜之父E.Ruska发明了世界上第一台透射电子显微镜,将人类带入超微世界。电镜分辨率约为0.2nm。

电子显微镜的工作原理是利用电磁透镜产生的磁场或电场折射电子束,然后通过电子束轰击荧光屏,激发荧光而成像。
发展至今,电镜已经衍生出多种其它的运用,如冷冻蚀刻、电镜酶化学、免疫电镜、电镜自显影、电镜3D重构等等,这些都大大增加了电镜在生物医学中的应用范围。甚至,部分肿瘤的诊断也依赖于电镜照片。但是电镜也不是完美的,电镜观察的视野太小,必须有光镜观察结果辅助,就是说,电镜+光镜是标配。
无论电镜的应用如何衍生发展,电镜生物样本的取材和制备依然是重中之重。
2.电镜样本采集
电镜样本制备大致可分为8步:取材→前固定(戊二醛)→后固定(锇酸)→脱水→浸透→包埋→切片→重金属电子染色。
电镜取材要求:
(1)组织取材:
切除组织要快,1min内即要浸入电镜前固定液(戊二醛必须要提前预冷至4℃)。组织块大小一般1.0mm*1.0mm*1.0mm,允许切成2×1×1mm长形小条,用以区分组织方向,但是观察面需与长轴垂直。选择部位准确无误,无关部分必须切去。全程操作需保持在0-4℃的环境中,防止组织自溶。
在此,我“墙裂”建议指派课题组内心灵手巧的女孩子做组织取材工作,杜绝手残党(逃......)
3.组织块取材注意事项:
①取材器械必须锋利,切勿牵拉、挤压组织块。
②如果取材样本数量较少,那么小编建议你可以将取出的组织块放在洁净的卡片纸上,滴一滴4℃的前固定液在上面然后快速修块(万不可直接修块,因为小块组织非常容易干燥且受到周围环境影响)。
③如果你需要取材组织很多,来不及现场修块。我建议你可以取材时先取适宜的大块浸入前固定液固定后1小时后再修块。(万不可现场强行修块,等你修好了,组织细胞也差不多自溶了。)
④特别复杂的结构需原位灌注固定后取材。若涉及骨组织取材,首选需脱钙处理,常规脱钙即可。
(2)贴壁细胞:
培养液倒掉;加入预冷至4℃的前固定液,固定15min;用细胞刮子轻轻将将细胞刮下;以2000-3000转/分钟离心10min,使细胞在离心管底部的尖端沉淀结块。
(3)悬浮细胞:
加入等量预冷至4℃的前固定液,固定30min;以1000转/min离心5min使细胞沉淀;把上清液吸掉;再加入预冷至4℃的前固定液,固定30min;以2000-3000转/min离心15min,使细胞沉淀结块。
可以看出,细胞的电镜制备也是将细胞制备成组织块的样子,因此后期的过程可大致将其视为组织块处理。
4.电镜样本固定
电镜样本固定分为前固定和后固定。
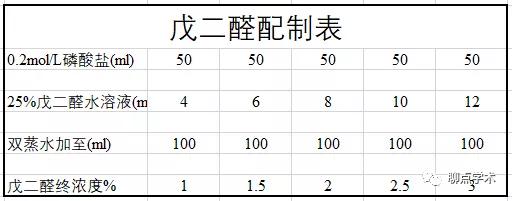
(1)戊二醛前固定
戊二醛(C5H8O2)的穿透性强,能够较好的保存微细结构,长时间(如1-2月)的戊二醛固定对于电镜组织样本影响不大。但戊二醛对组织抗原有一定影响,戊二醛还无法保存脂肪组织,并且戊二醛对细胞膜的显示显示效果不好。
一般来说,戊二醛PH为4.0-5.0。我建议用之前可以拿PH试纸或PH计测一下,如果戊二醛的PH降到3.5以下,则坚决弃用。平时放在4℃冰箱保存即可。
前固定一般采用2%-4%戊二醛固定1-2小时即可,配制后的PH溶液PH应该在7.3-7.4之间,固定前必须要预冷至4℃,戊二醛使用体积:组织块体积约40:1即可。
(2)磷酸盐缓冲液漂洗
漂洗时在4℃环境下,磷酸盐缓冲液漂洗0.4-2小时即可,中间需换液2次。
这里我介绍2种漂洗缓冲液,都可以用。
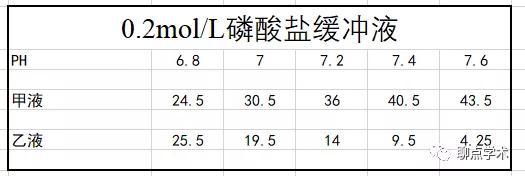
①:0.2mol/L磷酸盐缓冲液(可用于配制戊二醛溶液)
甲液:Na2HPO4 · 2H2O 35.61g加双蒸水定容到1000ml
乙液:NaH2PO4 · H2O 27.60g加双蒸水定容到1000ml
②:Milloning磷酸盐缓冲液(后面可再次用于配制锇酸)
甲液:2.26% NaH2PO4 · H2O 水溶液
乙液:2.25%NaOH水溶液
丙液:5.4%葡萄糖水溶液
丁液:41.5ml甲液+8.5ml乙液
终液:5ml丙液+45ml丁液,PH为7.3。
(3)锇酸后固定
锇酸的渗透性较弱,每小时仅渗透0.1-0.3mm的组织,一般需要固定2小时。千万不要过久地固定,因为锇酸可以使得组织变得很硬。锇酸在受热和见光时极易分解,同时锇酸中还含有葡萄糖,该液易变质,所以需要现用现配,不可长期储备。
市售的锇酸配制时一般为2%。但是锇酸固定一般选用1%浓度,在4℃环境中固定1-2小时,PH为7.3-7.4。锇酸固定后也要用缓冲液漂洗至少20min,才能进入脱水环节。
锇酸固定液配制方法:2%锇酸固定液5ml+10.8%葡萄糖0.5ml+Miilloning缓冲液4.5ml。配制后放置在4℃,避光,密封,2天以上才能完全溶解。如果锇酸变色,那就不要再用了。
对了,还有很重要的一点,配制过程全程所有试剂千万不要接触金属。
5.电镜样本脱水
电镜样本脱水可选用乙醇或丙酮。
(1)50%乙醇或丙酮,脱水15min;
(2)70%乙醇或丙酮,脱水15min;
(3)80%乙醇或丙酮,脱水15min;
(4)90%乙醇或丙酮,脱水15min;
(5)100%乙醇或丙酮,脱水20-30min;
脱水的第一步比较重要,我建议从低浓度的50%乙醇或丙酮开始。有的朋友可能因为赶时间,直接从高浓度70%或者80%开始。这样其实不好,因为之前组织样本处在一个水合环境下,如果突然进入高浓度的脱水液会导致组织快速脱水,组织块收缩严重,极易影响组织中超微结构的原位,个人这一点很重要。
电镜样本浸透与包埋
电镜样本浸透与包埋可不是用石蜡哟,而是使用环氧树脂+硬化剂。这一点大家可以自行选择市售的即可。需要注意的是,环氧树脂在冬天和夏天浸透与硬化的速度有些许区别,大家可适当调整环氧树脂+硬化剂的比例。我建议大家将冬夏两季的试剂区分开来使用。(全年恒温土豪实验室可忽略此条。)
组织充分脱水后,先使用包埋剂浸透30min-数小时,然后再另用新的包埋剂浸透30min,最后包埋即可。
包埋时可使用配套的特定模具,如果没有,可以找药用的空心胶囊,将组织块用牙签转移到胶囊底部,灌满包埋剂后放到60℃烤箱中,烤24-36小时即可。梯度升温可以,但是考虑到大家时间都很紧张,我就不介绍了。
6.电镜样本修块和制片
电镜样本修块没啥特殊的。
大家知道削铅笔吧,把胶囊削成该形状,注意不要把组织给削没了。电镜组织切片要求为超薄片,一般为40-50nm。可以预先削出0.5-2μm的厚切片。
超薄切片可不是用载玻片承载的,而是配套的3mm直径铜网,以便接受电子束的轰击。
7.电镜样本染色
一般使用重金属作为染色剂,常用的是醋酸铀或者柠檬酸铅。染色时既可以整块组织染,也可以切片染,这都没问题。
介绍醋酸铀染色方法。
常用浓度为2%-5%,用50%-70%乙醇或者丙酮配,还可以直接使用双蒸水配制,二者使用条件不同。
(1)组织块染色:当组织脱水至70%乙醇或者丙酮时将组织70%乙醇或者丙酮配制的饱和醋酸铀中,染色2.5小时或者放到冰箱中过夜染色也行。
(2)切片染色:找一个干净的培养皿,在培养皿上放一小块干净的石蜡块。然后把染色液滴到石蜡上,将上一步制备好的超薄切片连同铜网一起,反扣在染色液上,保持20min。再用双蒸水快速洗干净。小编提醒,一定要将铜网洗干净,否则时间久了铜网上溶液长铜锈和结晶体,这样搞不好得换铜网了。
科学指南针是杭州研趣信息技术有限公司推出的主品牌,专注科研服务,以分析测试为核心。团队核心成员全部来自美国密歇根大学,卡耐基梅隆大学,瑞典皇家工学院,浙江大学,上海交通大学,同济大学等海内外名校,为您对接测试的项目经理100%具有硕士以上学历。我们整合高校/社会闲置仪器设备资源,甄选优质仪器,为广大科研工作者提供方便、快速、更具性价比的分析测试服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2021-10-21
2021-10-21
 5659
5659
 1
1










