【摘要】 深度解读冷冻电镜技术核心原理,揭秘快速冷冻、低剂量成像关键技术,分析其在生物大分子结构解析与敏感材料研究中的突破性应用,包含样品制备全流程及未来发展方向。
技术革新背景
传统电子显微镜在生物研究领域存在显著局限:含水样品易受电子束损伤、冰晶干扰成像等问题长期制约科研进展。冷冻电镜(Cryo-EM)通过快速冷冻固定技术与三维重构算法的结合,成功突破分辨率瓶颈,成为解析蛋白质等生物大分子结构的革命性工具。
核心技术解析
1. 超快速冷冻技术
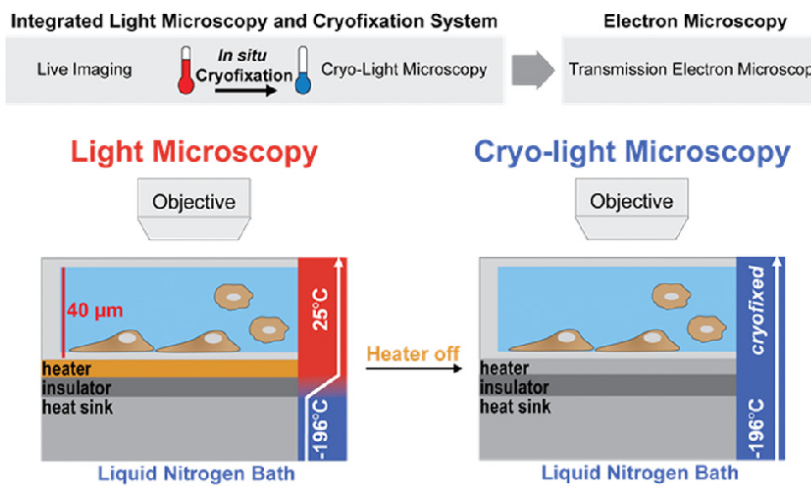
图1. 原位冷冻固定示意图[1]
- 冰晶干扰破解:传统冷冻方法中,水分子因氢键作用形成冰晶,破坏样品微结构。通过每秒10^4-10^6K速冻技术,水分子直接凝固为非晶态玻璃冰,保留生物分子天然构象。
- 液态乙烷介质优势:相比液氮,液态乙烷具有更高热传导效率,确保冷冻速率达微秒级,避免冰晶生成。
2. 低剂量电子成像
- 辐照损伤控制:生物样品对电子束敏感,累计剂量超过10e⁻/Ų即造成结构破坏。冷冻电镜采用**<5e⁻/Ų超低剂量成像**,配合低温保护(-180℃),延长有效观测时间。
- 信号增强策略:通过冷冻样品固定、直接电子探测器(DDD)与运动校正算法,在低信噪比条件下提取有效结构信息。
三维重构技术突破
单颗粒分析VS电子断层扫描
|
技术类型 |
成像原理 |
分辨率特性 |
应用场景 |
|---|---|---|---|
|
单颗粒冷冻电镜 |
百万级同构粒子投影图像叠加 |
各向同性≤1.5Å |
均质生物大分子 |
|
电子断层扫描 |
多角度投影重构 |
各向异性~20Å |
细胞器、病毒颗粒 |
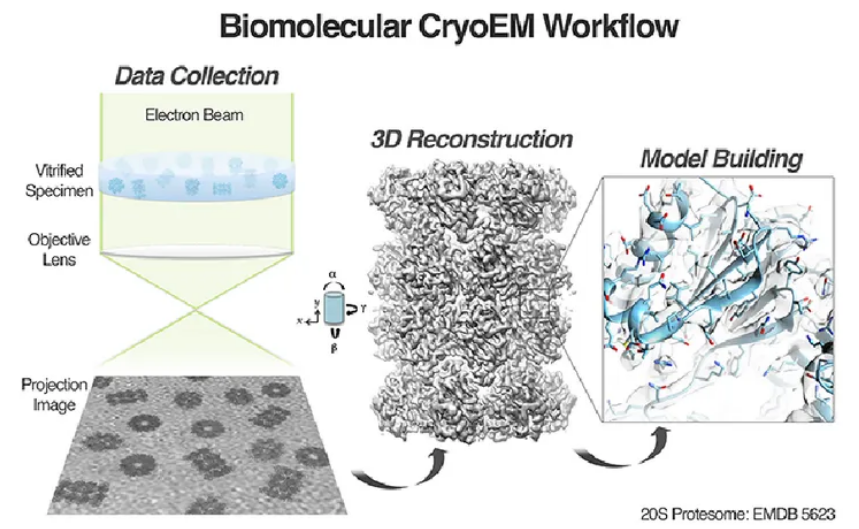
图2. Cryo-EM工作流程示意图
算法进化里程碑
- 初始模型构建:随机圆锥重构(Random Conical Tilt)突破相位问题
- 分类优化:RELION 3.0实现多构象态粒子分类
- 分辨率提升:基于深度学习的Topaz-Denoise算法实现2Å级噪声抑制
跨学科应用拓展
生物医学领域
- 病毒结构解析:新冠病毒刺突蛋白动态构象研究
- 药物靶点发现:GPCR受体与配体互作机制可视化
材料科学突破
|
材料类型 |
研究难点 |
冷冻电镜解决方案 |
|---|---|---|
|
钙钛矿薄膜 |
电子束诱导相变 |
低剂量+快速冷冻保持晶界 |
|
水凝胶网络 |
含水结构真空坍塌 |
玻璃态冰固定多孔结构 |
|
量子点组装体 |
表面配体动态分布观测 |
毫秒级冷冻捕获瞬态状态 |
技术发展前瞻
1.硬件升级方向:场发射枪(FEG)与相位板组合提升衬度
2.算法创新重点:多尺度建模融合X射线晶体学数据
3.产业转化路径:冷冻电镜服务平台的标准化建设
参考文献:[1] Fuest M , Nocera G M , Modena M M , et al. Cryofixation during live﹊maging enables millisecond time orrelated light and electron microscopy[J]. Journal of Microscopy, 2018, 272(2).
科学指南针以分析测试为核心,提供材料测试、环境检测、生物服务、模拟计算、科研绘图等多项科研产品,累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。始终秉持“全心全意服务科研,助力全球科技创新”的使命,致力于为高校、院所、医院、研发型企业等科研工作者提供专业、快捷、全方位的服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-05-15
2025-05-15
 3998
3998
 0
0










