【摘要】 以微生物为生物指示剂的急性毒性试验是反映水污染对生物体影响的有效工具。
以微生物为生物指示剂的急性毒性试验是反映水污染对生物体影响的有效工具。到目前为止,微生物的悬浮状态仍然是主要的,因为微生物的固定状态会由于微生物的重复使用而导致毒性试验的稳定性差。本文建立了一种基于生物膜的电化学生物传感器(TOX生物传感器),证明了固定化微生物在生物膜中的应激反应是导致TOX生物传感器不稳定的主要因素,并且可以通过剂量和时间积累来诱导。测量有毒物质缺乏时的应激反应强度是存在时的三倍,表明细胞外物质可用于微生物修复,并导致内源性物质消耗的减少。在本研究中,弱磁场(WMF)被用于平衡现有TOX生物传感器中生物膜的活性,低强度的WMF 10 GS被证明具有减弱应激反应的功能。在此条件下,生物传感器的信号可以稳定一个月,休眠TOX生物传感器的恢复时间可以从50小时缩短到10小时。其机理可能与生物体内的特殊磁场和生命活动过程中发生的电荷转移有关。
化学制品:NaCl、K2Cr2O7、Cd(NO3)2、Pb(NO3)2、HgCl2、ZnCl2、CuCl2、葡萄糖和谷氨酸从北京化工厂(中国北京)获得。3,5-二氯苯酚(DCP)、5-磺基水杨酸脱水物、对氯酚、二苯胺、9,10-二苯基蒽和2-氯蒽醌购自Aldrich。本工作中使用的储备溶液如表S1所示。通过混合1.5 g L-1葡萄糖和1.5 g L-1谷氨酸制备储备呼吸底物(RS)溶液,该溶液由APHA方法(APHA,1997)描述,最初用作生化需氧量(BOD)标准溶液,因为含有碳源和氮氧化物源。在这里,该溶液也被用作标准RS溶液,因为其BOD值为1980 mg L-1(GGA1980),可以转换为其他特定稀释值,这有利于比较RS的效果。除非另有说明,本工作中使用的所有试剂均为分析级试剂,并在收到时使用。所有水溶液均采用超纯水(>18μ)从Milli-Q Plus系统(微孔)制备。生物传感器。氧型生物传感器由生物膜反应器(BFR)、流动系统和电化学系统组成。生物膜沉积在根据我们之前的报告制备的GelrGONR上,并放入直径为1cm、高度为2cm的有机玻璃管中。对于生物膜培养,将BOD种子(E-05466-00,Cole Parmer)接种在LB培养基(10 g L1胰蛋白胨、5 g L-1酵母抽提物和10 g L-1 NaCl,pH 7)中,并在37°C下通过流动系统持续循环。温度由恒温器保持(中国志成)。流量系统由一台泵(中国保定BT100-1 J)、三个电磁阀(RSD小于4.95%)和一个分配控制器(中国多维TPC 16-16TD)驱动,以控制传感器的采样顺序和运行时间。溶解氧(DO)被用作电化学探针,因为其浓度会因微生物呼吸而改变。使用电化学分析仪(CHI832,中国上海CHI有限公司)作为信号采集器。对于DO的电分析测量,使用了传统的三电极系统,金电极(2 mm)对Ag/AgCl(饱和KCl)参比电极的电位设置为700 mV,铂用作对电极。当不使用时,通过持续泵送PBS(0.08 M KH2PO4和0.12 M Na2HPO4,pH 7)将生物传感器保持在流动系统中。所有溶液均用去离子水消毒。WMF。通过安装一对永磁体(长方体,每个0.3厘米1厘米2厘米)获得弱磁场(WMF)。永磁体沿着反应堆轴线连接到一对可拆卸板上,可用于调节WMF的强度。WMF的强度由手持高斯计测量(科利G92,德国)。形态学研究。微生物细胞的超薄切片用于透射电子显微镜(TEM)成像。首先,用2.5%戊二醛固定12h,然后在室温下用1%四氧化锇固定2h,然后用分级乙醇系列(50%、70%和90%)脱水15min,然后用100%乙醇脱水3次,每次10min。将样品嵌入Epon 812树脂中并聚合8小时以获得固体嵌段。样品块的超薄切片(50e70 nm)由徕卡UC 6切片机(奥地利维也纳徕卡)和金刚石刀(瑞士硅藻)切割。使用H-7650 TEM(日立,茨城,日本)在80 kV加速电压下获得TEM图像。对于AFM图像,使用消毒镊子将样品放置在新处理的样品台上。所有图像均来自一个轻敲模式原子力显微镜多模8-HR(Bruker),探针模型为ScanaySt-FLUIDþ。
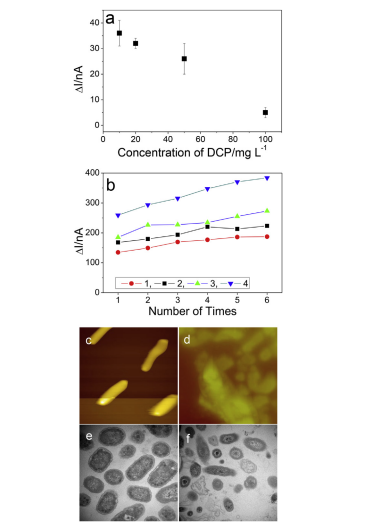
图1 (a) 通过仅添加DCP作为外源物质进行DI。(b) 通过交替添加GGA和GGAþDCP进行六个连续周期的毒性试验,1至4表示连续四天内GGA的信号。新鲜微生物(c和e)的AFM和TEM图像,并用于毒性分析(d和f)。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-03-23
2022-03-23
 2894
2894
 0
0










