【摘要】 通过PV1基因敲除小鼠模型,解析血管内皮细胞隔膜透气率对血浆蛋白及脂代谢的调控机制。揭示PV1蛋白缺失导致的生长缺陷、腹水积聚及进行性脂质沉积病理过程,为血管通透性疾病研究提供新见解。
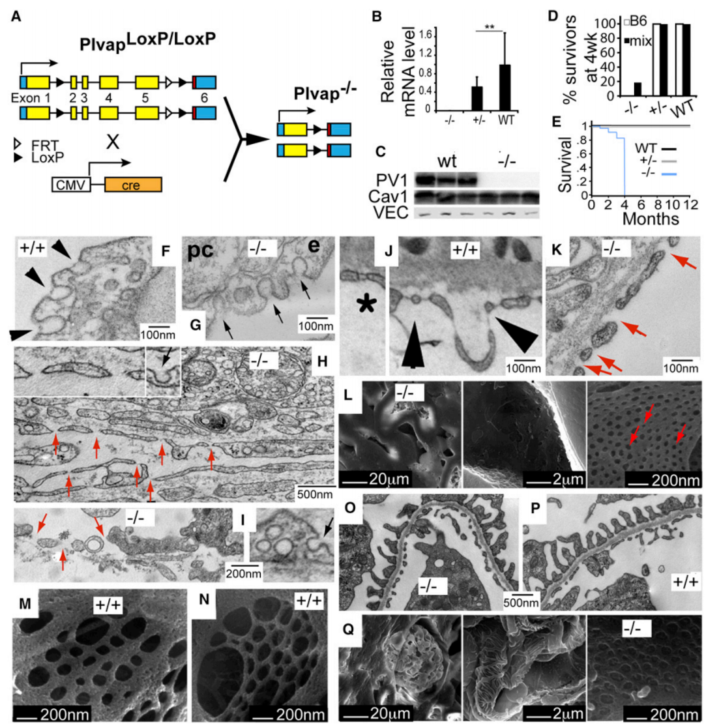
图1 缺乏PV1导致内皮隔膜缺失和存活率下降
为探究PV1蛋白在血管屏障功能中的作用,研究团队构建了Plvap基因位点特异性敲除小鼠模型(PV1L/L)。通过CMV cre重组酶系统实现全身性PV1蛋白敲除(图1A)。Western blot及qPCR结果显示,突变体小鼠mRNA(图1B)和蛋白表达(图1C)均显著降低,证实模型构建成功。
研究发现,PV1缺失导致严重生存缺陷:纯合敲除小鼠在C57Bl/6J背景中胚胎期13天至出生后2天全致死。但在混合基因型(Balb/c-C57Bl/6J-129Sv/J)中,20%的PV1-/-小鼠可存活至3-4月龄(图1D)。这一发现为研究出生后血管屏障功能提供了关键模型。
存活突变体呈现显著表型变化:
1️⃣ 出生4周后体重下降30-40%(图1F)
2️⃣ 体长缩短15%伴脂肪组织减少(MRI显示腹膜后脂肪减少,图1G)
3️⃣ 胰腺发育异常(图S1I显示器官/体重比变化)
4️⃣ 进行性腹水积聚(未展示数据)
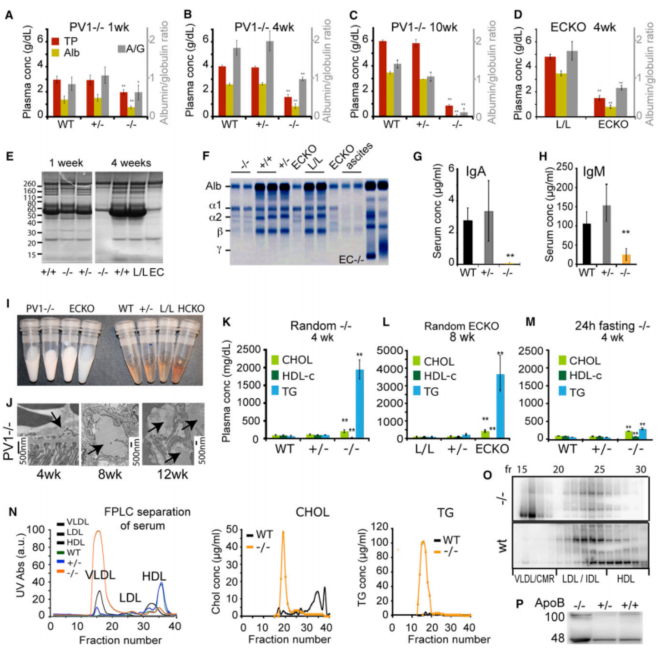
图2 PV1–/–小鼠逐渐发展为严重的低蛋白血症和高甘油三酯血症
脂代谢研究揭示关键机制:
✅ 2周龄前血浆指标正常
✅ 4周龄出现明显高甘油三酯血症(图2I显示乳糜血浆)
✅ 8周后器官表面出现黄色瘤(图2E心脏表面脂质沉积)
✅ 10-12周血管周脂质浸润(图2J右)
该研究验证了血管内皮屏障对脂蛋白代谢的调控作用:
? PV1蛋白缺失导致内皮孔径异常扩大
? 大分子脂蛋白(如ApoB48)无法正常代谢
? 外周组织LPL活性降低加剧脂质沉积
参考文献:[1] Shearer, G.C., and Kaysen, G.A. (2006). Endothelial bound lipoprotein lipase (LpL) depletion in hypoalbuminemia results from decreased endothelial binding, not decreased secretion. Kidney Int. 70, 647–653.
[2] Yoshino, G., Hirano, T., Nagata, K., Maeda, E., Naka, Y., Murata, Y., Kazumi, T., and Kasuga, M. (1993). Hypertriglyceridemia in nephrotic rats is due to a clearance defect of plasma triglyceride: overproduction of triglyceride-rich lipoprotein is not an obligatory factor. J. Lipid Res. 34, 875–884.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,提供材料测试、高端测试、环境检测、生物服务、模拟计算、科研绘图、数据分析、试剂耗材、行业解决方案、指南针学院等多项科研产品和服务矩阵。企业致力于为高校、科研院所、医院、研发型企业等科研工作者,提供专业、快捷、全方位的检测及科研服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-04-16
2025-04-16
 1564
1564
 0
0










