【摘要】 借助配分函数,可以根据以下基本热力学公式导出熵和吉布斯自由能的解析表达式
氮气(N2)在石油和天然气工业中被广泛使用。Chun-Sheng Jia等人[1]报道了纯气态物质摩尔熵和吉布斯自由能的两种新的有效闭合形式表示。
借助配分函数,可以根据以下基本热力学公式导出熵和吉布斯自由能的解析表达式:
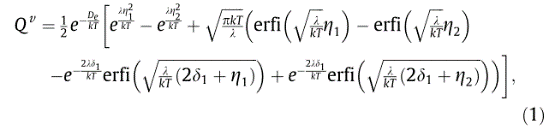
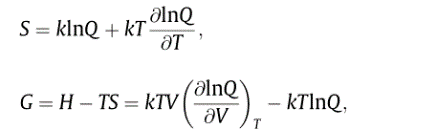 (2)
(2)
在上述方程中,S表示熵,G表示吉布斯自由能,H表示焓,V是每个分子所占据的体积。将方程(1)中给出的振动配分函数代入上述方程,分别获得了摩尔振动吉布斯自由能的以下表达式:
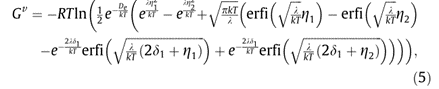
其中P表示气体压力。通过将公式(2)应用于方程分别获得摩尔平移和旋转吉布斯自由能如下:
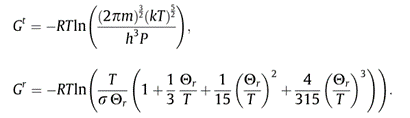
为了获得所建立的摩尔熵和吉布斯自由能预测模型,文章中应用所建立的模型计算了N2气体的熵和吉布斯自由能,并将预测结果与实验数据进行了比较。氮原子有两种同位素:14N(99.635%)和15N(0.365%)。只考虑最丰富的氮分子(14N2)。氮的分子质量为m=4.65173 × 10-26 kg。考虑到N2激发态的贡献,在方程的右边增加了附加项。
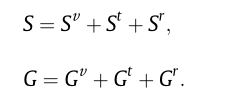
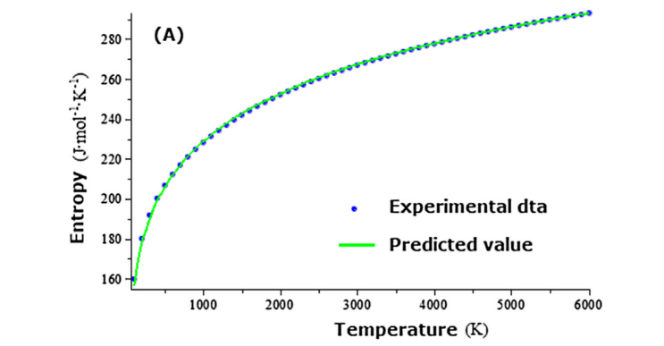
本工作中提出的新熵和吉布斯自由能预测模型仅与每个纯物质的三个分子常数De、γe和ωe有关。该模型避免了大量实验光谱数据的需要,为快速确定纯物质系统的熵和吉布斯自由能提供了一种方法。这里R是考虑激发态贡献的经验项,目前还不能对IR项的起源给出满意的解释。摩尔熵随温度的变化如图所示,其中绿色实线代表预测值,蓝色实圆代表来自NIST数据库的实验数据。从图可以看出,在1 bar压力下,在100 ~ 6000 K的温度范围内,氮的预测熵值与实验值非常吻合。
预测值与实验值的比较表明,在100–6000 K的温度范围内,N2的摩尔熵和吉布斯自由能可以很好地预测。目前的熵和吉布斯游离能预测模型只需要三个分子常数的实验值,并且远离了大量实验光谱数据的利用。
[1]Jia, Chun-ShengZhang, Lie-HuiPeng, Xiao-LongLuo, Jian-XinZhao, Yu-LongLiu, Jian-YiGuo, Jing-JingTang, Lian-Dong.Prediction of entropy and Gibbs free energy for nitrogen[J].Chemical Engineering Science, 2019, 202.
科学指南针为超过6000家高校和企业提供一站式科研服务,2023年12月:已服务超过2000家高校,超过4000家企业,提供近500所高校研究所免费上门取样服务,平均每天处理样品数9000+、注册会员数60w+、平均4.5天出结果、客户满意度超过99%。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-05-30
2024-05-30
 3346
3346
 0
0










