【摘要】 综上所述,该研究多维度揭示了TAAR1受体的药理学机制,对未来精神分裂症、抑郁症等重大慢病的创新药物研发具有指导意义。
11月7日,四川大学华西医院生物治疗全国重点实验室邵振华-颜微研究团队,联合山东大学孙金鹏-于晓教授团队,在Nature杂志发表了最新研究论文“Ligand recognition and G protein coupling of trace amine receptor TAAR1”。四川大学华西医院为本课题第一完成单位和第一通讯单位;四川大学华西医院博士后徐政、申思远,及博士生于靖靖、吴超、赵畅为本文的共同第一作者(共7人);邵振华研究员和颜微研究员为本论文共同通讯作者。另外,生物治疗全国重点实验室魏于全院士和杨胜勇教授为本研究提供了重要帮助。

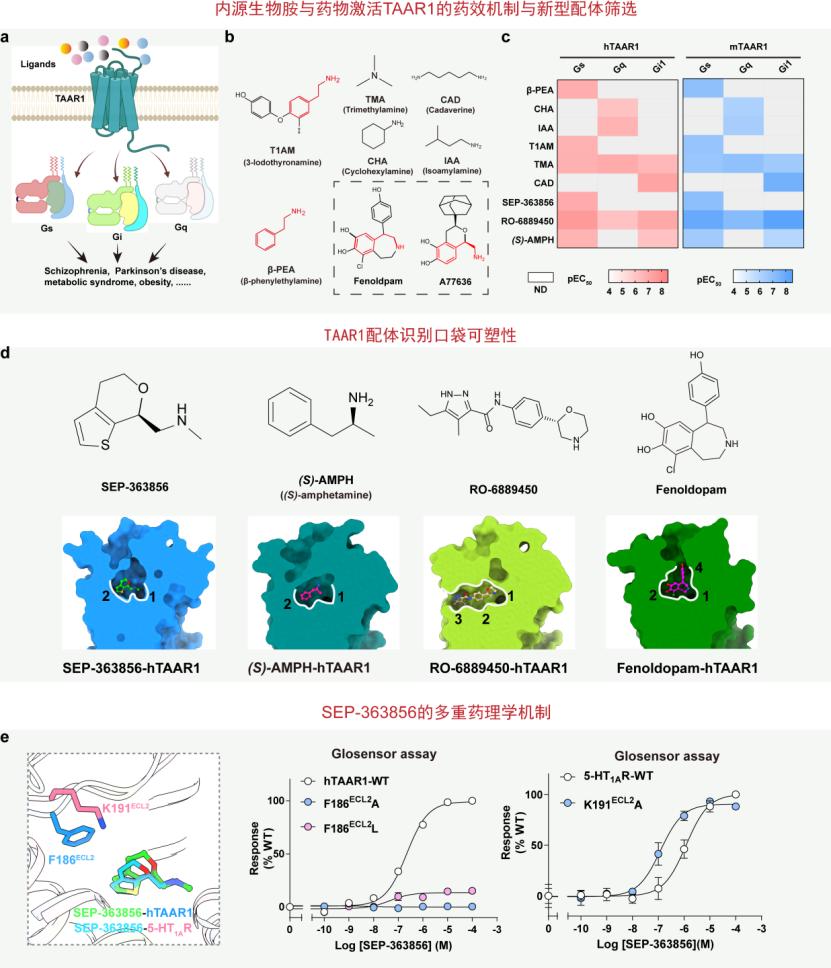
图1.TAAR1的药理学和分子机制a, TAAR1响应不同配体激活介导下游G蛋白信号示意图。b,TAAR1多样性配体结构。c,多样性生物胺激活人源TAAR1(hTAAR1)和鼠源TAAR1(mTAAR1)的G蛋白信号。d, TAAR1的配体识别口袋具有可塑性。e, SEP-363856激活hTAAR1和5-HT1AR的分子机制。
为了研究TAAR1与配体的药理学机制,研究团队探索了一系列内源性生物胺、临床药物等激活TARR1的多种G蛋白信号途径(图1b,c)。基于药物分子的构效关系,筛选了一系列相关化合物配体库,发现了儿茶酚胺类药物Fenoldopam和A77363(两者均是多巴胺受体的激动剂)能够激活hTAAR1(图1b)。不难发现,该类化合物分子具有与β-苯乙胺(β-PEA)相似的核心药效基团。
进一步如图1d所示,研究团队发现内源性生物胺和安非他命结合在受体的核心口袋(1和2),此外,临床药物RO-6889450又占据了受体中新型隐式位点-3,儿茶酚胺类药物Fenoldopam占据了受体中新型隐式位点4,该发现阐明了TAAR1的口袋可塑性,解释了多样性配体识别的药理学机制。
抗精神分裂症的经典药物大多数作用于多巴胺受体,而SEP-363856作为非多巴胺受体的新一代抗精神病临床药物,在药物研发历史上具有重要的里程碑意义。研究表明SEP-363856作为TAAR1的完全激动剂和5-HT1AR的部分激动剂,该研究探索了SEP-363856对TAAR1与5-HT1AR双靶点的作用机制,揭示了两类受体中的通用识别基序;进而发现了TAAR1中的F186位点对SEP-363856的识别和受体激活起关键作用(图1e),相对应,5-HT1AR中的K191对SEP-363856的识别并未有影响。
综上所述,该研究多维度揭示了TAAR1受体的药理学机制,对未来精神分裂症、抑郁症等重大慢病的创新药物研发具有指导意义。











 您已经拒绝加入团体
您已经拒绝加入团体

 2023-11-16
2023-11-16
 3025
3025
 0
0










