【摘要】 参比电极(Reference electrode):参比电极具有已知恒定的电位,为研究对象提供一个电位标准。测量时,参比电极上通过的电流极小,不致引起参比电极的极化。
参比电极(Reference electrode):参比电极具有已知恒定的电位,为研究对象提供一个电位标准。测量时,参比电极上通过的电流极小,不致引起参比电极的极化。
理想的参比电极必须具备如下性质:
(1)电极表面的电极反应必须是可逆的,电解液中的某化学物质必须服从能斯特平衡电位方程式(也称为Nernst效应).
(2)电极电位随时间的漂移小.
(3)流过微小的电流时,电极电位能迅速恢复原状(不产生滞后现象) .
(4)像Ag/AgCl那样的电极,要求固相不溶于电解液.
(5)当温度发生变化时,-定的温度能相应有一定的电位(没有温度的滞后) .
实验室常用的参比电极主要有以下三种:
A. 氢电极
氢电极最经常被用作为电极电位的基准.氧化还原电位几乎都是以其为基准测定出来的.这主要因为,其反应:
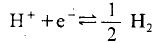
是最基本的反应,而且几乎具备了上述所列举的作为参比电极应具备的所有条件,尤其是电位重现性极佳。
[NHE]
NHE指的是标准氢电极( Normal Hydrogen Electrode 的缩写),为了满足氢离子和氢气的活度为1时的电位即Eø为电极电位的基准,其值为0,氢电极经常使用pH=0的电解液。所以有时也叫做SHE。
[RHE]
参比氢电极(RHE)是具有与测定溶液的pH相同pH值电解液的氢电极。使用RHE时,由于作用电极室和参比电极室使用同一电解液,不用考虑溶液间的电位差,实验上非常方便。
B.甘汞电极(Calomel electrode):甘汞电极是实验室最常用的参比电极之一,它的电极反应是:Hg2Cl2 + 2e-= 2Hg + 2Cl-,其电位与氯离子的浓度有关。当溶液中的KCl达到饱和时,叫做饱和甘汞电极(SCE),饱和甘汞电极电位对温度很敏感,25 ℃时,标准电极电位为0.2412 V;KCl浓度为1 M时的电极电位为0.2801 V;KCl浓度为0.1 M时的电极电位为0.3337 V。
C.银氯化银电极(Ag/AgCl):银氯化银电极也是实验室最常用的参比电极之一,其电极反应为:AgCl + e-= Ag + Cl-,其电位也受Cl-浓度的影响。电极电位因电解液KCI浓度的不同而变化,另外,其同样对温度变化很敏感。25C时,
在饱和KCl溶液中为0.199 V(vs. NHE);
在3.5M KCI 溶液中为0.205 V(vs. NHE)。
了解了这些之后,可能又有同学要问了,在电化学实验过程中,什么情况考虑用三电极,什么时候考虑用两电极?还有四电极又是干嘛用的?所以,下一期我们好好讲讲它们之间的区别以及各自的应用范围。
参考文献
《电化学测定方法》藤岛昭等著,陈震等译
科学指南针提供各类科研测试服务,愿您总能获得想要的结果。我们收到的测试样品来自各地,种类繁多,如果我们回复不及时,还请再次联系,或直接语音电话联络,若您对我们的服务不满意,或对测试结果有疑问,请果断联系我们或直接拨打400-831-0631,我们对每个数据及结果,会负责到底!科研可能很苦,但坚持一定很苦,愿您顺利!
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-01-17
2022-01-17
 17215
17215
 0
0










