【摘要】 随着指南针平台的业务范围扩大,越来越多的小伙伴来咨询蛋白质二级结构的测试。于是,小铅笔专门用一期推文给大家介绍红外光谱在蛋白质二级结构中的应用。
蛋白质有多级结构,最热门的研究可能是用XRD,NMR和冷冻电镜测试蛋白质的三级结构,其精度之高是别的方法无法比拟的。Step1蛋白质单晶培养—Step2冷冻电镜测试三级结构—Step3软件分析药物与蛋白质的作用,三部曲研究让许多实验室实现了量产NSC(Nature,Science,Cell),创造了许多科研神话。
但蛋白质晶体的培养难度大,周期长;蛋白质结构解析难度大这两座大山却难到了很多同学。
问:有没有无需蛋白质的晶体培养,也不用高端的分析仪器研究蛋白质二级结构的方法呢?
答:或许,你可以试试红外光谱研究蛋白质二级结构。
红外光谱凭借免蛋白质单晶培养+操作简单+数据好分析三大优点,在蛋白质二级结构定性或半定量研究中得到了广泛的运用。
结合合适的数据处理方法,我们就能得到下面这样紧紧抓住审稿人眼睛的美丽图片!
这里,我们将从样品制备到分析测试介绍红外光谱测试蛋白质的二级结构。
第一步:样品制备
如果不考虑溶剂效应,可选冻干/氮吹法,将蛋白质样品制备成粉末,选择透射或ATR测试。冻干和氮吹的目的主要是保留蛋白质活性。
如果反应需要考虑溶剂效应,可以考虑用液体池或者ATR进行测试。
当然,如果蛋白质活性和溶剂效应都不考虑。那么可以采用自然干燥+ATR测试,实现蛋白质分析的免制样+可回收。
第二步:数据处理
数据处理是研究蛋白质二级结构的亮点所在。根据不同的需要,我们可以选择不同的处理方法:
a. 原始光谱/导数光谱定性比较二级结构变化;
b. 分峰拟合半定量分析二级结构变化;
c. 二维光谱研究蛋白质热稳定性;
d. 二维光谱鉴别变性前后的蛋白质。
第三步:数据解释
蛋白质二级结构变化的原因主要是原有维持二级结构的氢键被破坏。造成蛋白质中氢键被破坏的因素有温度变化;蛋白质骨架中加入金属离子;光照诱导蛋白质分子链断裂;药物与蛋白质结合等等。
相关案例
红外光谱在蛋白质二级结构中应用颇多。例如温度(热变性)、光照(光变性)、pH值、金属离子,酶等因素对蛋白质结构的影响。希望通过下面的案例,能让蛋白质二级结构分析成为小伙伴们文章的创新点!
案例一:不同温度压力下,马血清蛋白的蛋白质二级结构变化(The secondary structure of pressure- and temperature-induced aggregates of equine serum albumin studied by FT-IR spectroscopy)
作者通过红外原始光谱比较温度和和压力对马血清蛋白质二级结构的影响,发现温度和压力都能改变蛋白质二级结构。但经过一个升温+降温过程后,蛋白质二级结构发生了明显不可逆变化,而升压+降压则对二级结构的影响较小。
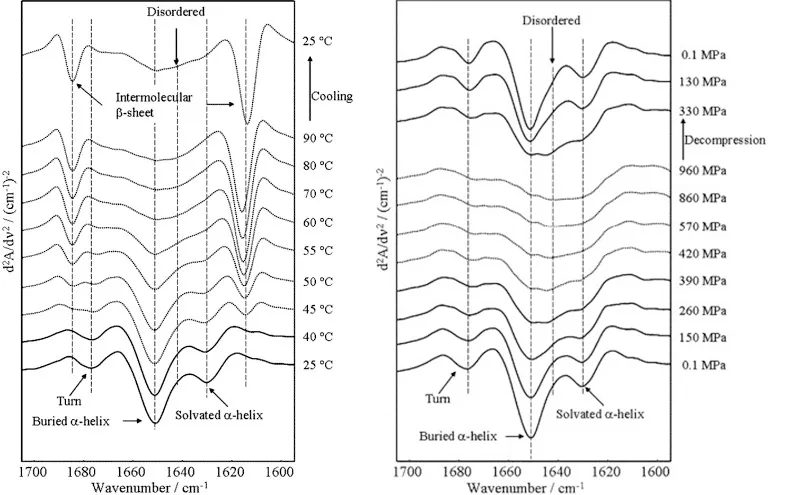
不同温度/压力下马血清蛋白二级结构变化
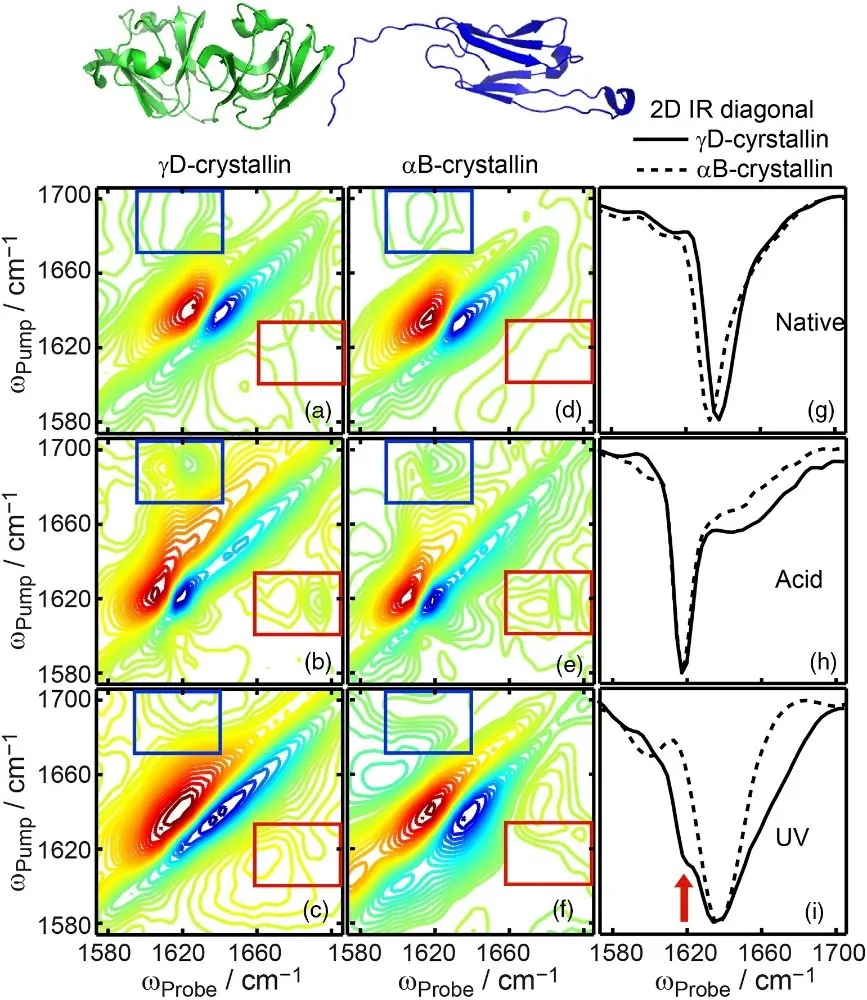
案例二 运用二维红外光谱鉴别淀粉样蛋白(Amyloid β-Sheet Secondary Structure Identified in UV-Induced Cataracts of Porcine Lenses using 2D IR Spectroscopy)
淀粉样蛋白是蛋白质变性的一大研究热点。作者通过设置微扰条件,对比了变性前后蛋白质的二维光谱,成功鉴别了淀粉样蛋白。红色和蓝色方框是两种蛋白质二维光谱的差异。
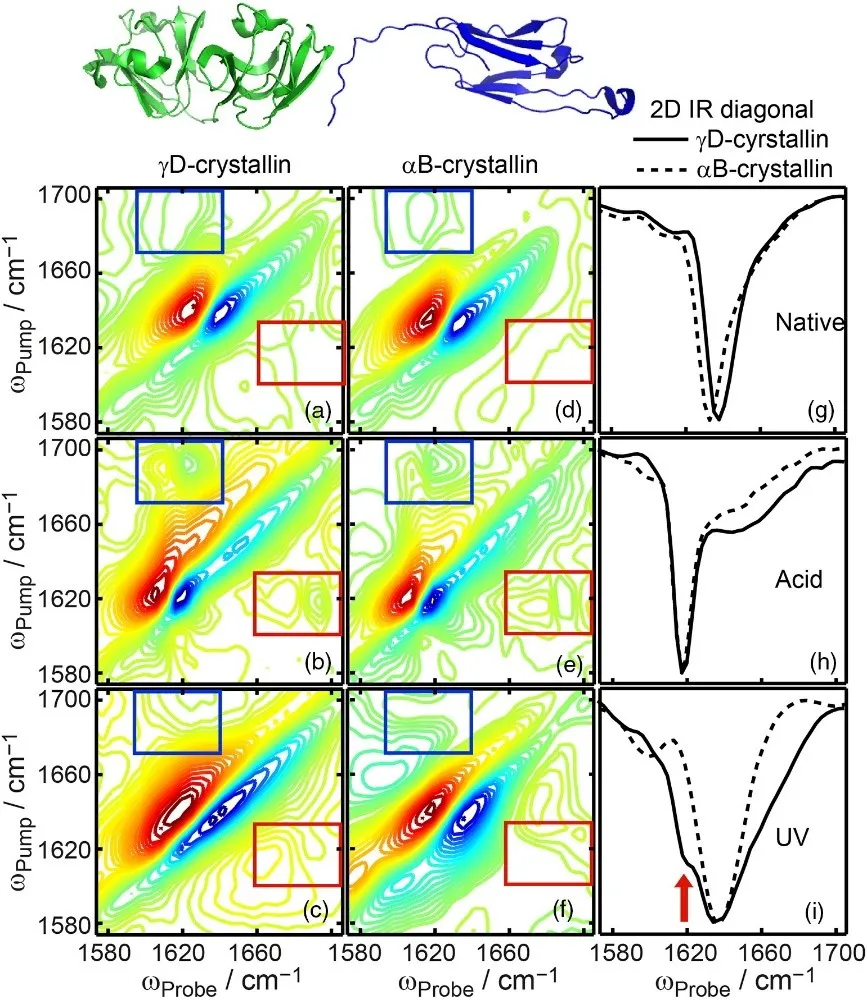
晶体蛋白中淀粉样蛋白质鉴别
案例三 研究不同pH值下蛋白质二级结构的变化(Correlation between the OmpG Secondary Structure and Its pH-Dependent Alterations Monitored by FTIR)
随着pH值的变化,蛋白质二级结构会发生不同程度的改变。作者运用导数光谱成功区分出四种二级结构所对应的吸收峰位,并比较了不同pH下蛋白质二级结构的微小差异。
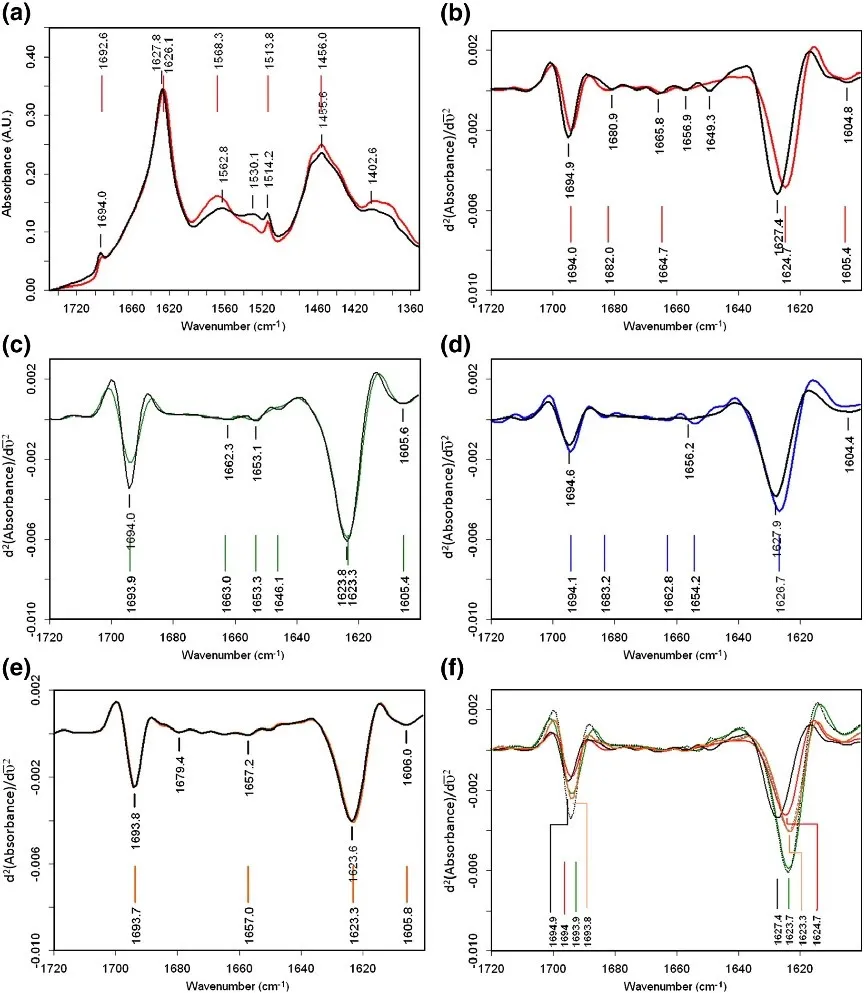
不同pH值下蛋白质二级结构的变化
案例四 通过研究蜂王浆在不同储藏温度下蛋白质结构变化选择合适的储藏温度(蜂王浆不同贮存条件下蛋白质二级结构的Fourier变换红外光谱研究)
为了选择合适的蜂王浆储藏温度,作者对比了不同储藏温度下蜂王浆蛋白质二级结构的相对含量变化。发现-18℃下,蜂王浆蛋白质二级结构改变最小。
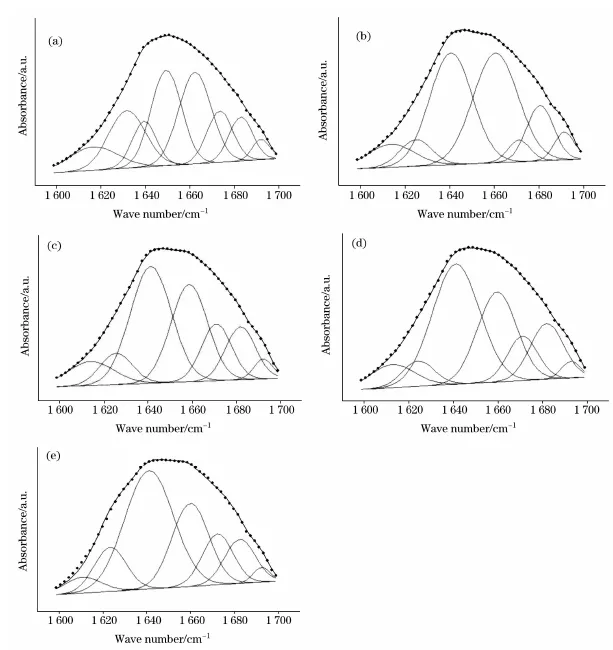
不同储存条件下蜂王浆不同贮存条件下蛋白质二级结构











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-01-04
2022-01-04
 7656
7656
 1
1










