【摘要】 紫外-可见吸收光谱(Ultraviolet Visible Absorption Spectroscopy),简称紫外光谱(属分子光谱),是物质的分子吸收紫外光-可见光区的电磁波时,电子发生跃迁所产生的吸收光谱。
紫外-可见吸收光谱(Ultraviolet Visible Absorption Spectroscopy),简称紫外光谱(属分子光谱),是物质的分子吸收紫外光-可见光区的电磁波时,电子发生跃迁所产生的吸收光谱。通常我们所说的紫外光谱其波长范围主要是为200~800nm(其中10~200nm为真空紫外区,由于空气对远紫外区的电磁波有强吸收,因此其光谱研究较少)。由于不同物质的分子其组成和结构不同,它们所具有的特征能级也不同,其能级差不同,而各物质只能吸收与它们分子内部能级差相当的光辐射,所以不同物质对不同波长光的吸收具有选择性。
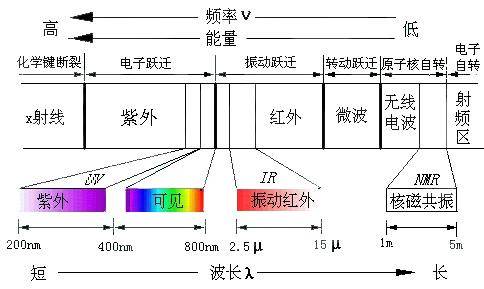
图一 光波谱区及能量跃迁相关图
物质对光具有选择吸收性,满足Beer-Lambert定律:
A=εcL=-㏒(I/I0)
其中,A为吸光度,ε为摩尔消光系数,c为溶液的摩尔浓度,L为液层厚度,I为透射光强,I0为入射光强。通过使用紫外光谱仪,使紫外光依次照射一定浓度的样品溶液,分别测得A,以A或ε或㏒ε作纵坐标,波长(nm)为横坐标作图,得紫外吸收曲线,此即紫外光谱。通过紫外-可见光谱及物质对于紫外光-可见光区的电磁波的吸收程度我们可以对物质的组成、含量和结构进行分析、测定、推断。
一、紫外光谱基本原理物质对紫外-可见光区电磁波的吸收将导致分子中的价电子从能量较低的分子轨道向能量较高的空的反键分子轨道跃迁。因此,在紫外光谱中观察到的吸收谱带往往对应于分子中某种形式的电子能级的跃迁。常见的有机分子中与价电子跃迁有关的分子轨道主要有:σ、σ*、π、π*、n,其能量高低为:σ<π n→σ*>π→π* >n→π*。
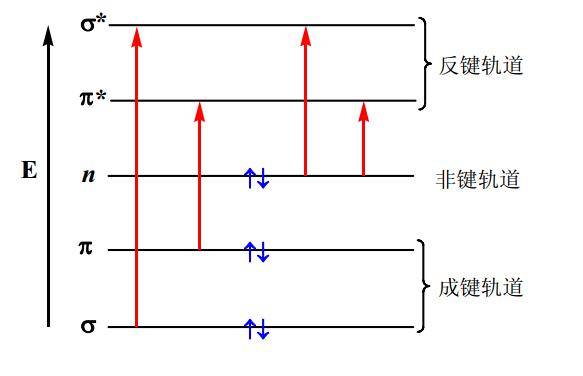
(1)σ→σ*一般饱和烷烃分子为此类跃迁,所需能量最大,吸收波长λmax <200,仅在远紫在外区通过真空紫外分光光度计才能检测到它们的吸收谱带。例如甲烷λmax =125nm、乙烷λmax 为135nm。
(2)n→σ*该跃迁为杂原子的非键轨道中的电子向σ*轨道跃迁,一般在150~250nm左右。原子半径较大的硫或碘的衍生物n电子能级较高,吸收光谱在近紫外220~250nm附近。含非键电子的饱和烃衍生物( N、 P、 S、 O和卤素原子)均呈现此类跃迁。
(3)π→π*π电子跃迁到反键π* 轨道所产生的跃迁,若无共轭,与n→σ*跃迁差不多,200nm左右;若有共轭体系,波长向长波方向移动( 200~700nm)。通常,含不饱和键的化合物发生π→π*跃迁,例如C=O 、C=C、 C≡C。
(4)n→π*电子跃迁到反键π* 轨道所产生的跃迁,这类跃迁所需能量较小,吸收峰在200~400 nm左右;比π→π*跃迁相比时,n→π*跃迁具有所需能量小、吸收波长长的特点。含杂原子的双键不饱和有机化合物,如C=S、O=N-、-N=N-会发生此类型跃迁。
事实上,最常用到的是π→π*和n→π*跃迁,这两种跃迁都需要分子中有不饱和基团提供π轨道。
二、常用术语(1)生色团(发色团)——含不饱和键的基团,有π键含有不饱和键,能吸收紫外可见光,产生 n→π* 或π→π*跃迁的基团称为生色团。如C=C、C=O、NO2等,其结构特征都含有π电子,当这些基团在分子内独立存在与其它基团或系统没有共轭或其它复杂因素影响时,它们将在紫外光区发生特定波长的吸收。
(2)助色团——含杂原子的饱和基团一些本身在紫外和可见光区无吸收,但能使生色团吸收峰红移(向长波移动) ,吸收强度增大的基团称为助色团。如: -OH、 -OR、 -SH、 -NR2、卤素等,其结构特点在于都带有n电子,当它们与生色团相连时,由于n电子与π电子的p-π共轭,形成多电子的较大共轭体系, π→π*跃迁能量降低,吸收向长波移动,化合物颜色加深。
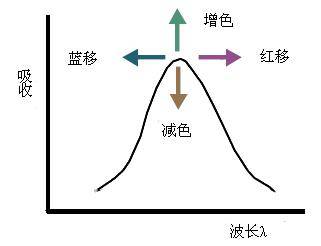
(3)长移与短移由于取代作用或溶剂效应导致生色团的吸收峰向长波移动的现象称为红移。凡因助色团的作用使生色团产生红移的,其吸收强度一般都有所增加,称为增色作用。由于取代基的作用或溶剂效应导致生色团的吸收峰向短波方向移动称为蓝移,相应地使吸收强度降低的作用称为减色作用。
(4)吸收带——吸收峰在吸收光谱上的波带位置a、R 吸收带:由n→π*跃迁引起,是含杂原子的不饱和化合物的吸收带。特点:跃迁所需能量较小,吸收峰位于200~400 nm;吸收强度弱, ε <100,为羰基的特征吸收谱带。b、K 吸收带:有共轭体系的π→π*跃迁引起,是共轭不饱和化合物的吸收带。特点:跃迁能量较R带大,吸收峰位于210~280nm;吸收强度强, ε>10000。随着共轭体系的增长,K吸收带长移, 210 ~ 700nm, ε 增大。K 吸收带是共轭分子的特征吸收带,可用于判断共轭结构,是应用最多的吸收带。c、B吸收带:由闭合环状共轭双键π→π*跃迁所产生的吸收带,它是芳环、杂芳环化合物的特征吸收带。如苯环的B带: λ=230~270nm,为含有多重峰或精细结构的宽吸收带。d、E吸收带:E带也是芳香化合物的特征吸收峰,也是由π→π*跃迁产生,分为E1、 E2带,二者可看成苯环中的大π键和共轭乙烯等键引起。
三、紫外光谱和有机分子结构关系紫外光谱适于分子中具有不饱和结构的特别是共轭结构的化合物。从紫外光谱中我们可以得到以下结构信息:a)、在210~250nm有强吸收,表示有K吸收带,则可能含有两个双键的共轭体系,如共轭二烯或α,β-不饱和酮等。同样在260,300,330nm处有高强度K吸收带,在表示有三个、四个和五个共轭体系存在。b)、在260~300nm有中强吸收(ε=200~1 000),则表示有B带吸收,体系中可能有苯环存在。如果苯环上有共轭的生色基团存在时,则ε可以大于10 000。c)、在250~300nm有弱吸收带(R吸收带),则可能有含杂原子的不饱和基团存在,如羰基等。
四、紫外-可见光光谱应用a)结构分析由于紫外-可见吸收光谱其谱图简单,吸收峰个数少,对于鉴定未知物的结构较为困难,主要表现出化合物的发色团和助色团的特征。因此,可利用紫外可见吸收光谱确定有机化合物中不饱和基团,还可区分化合物的构型、构象、同分异构体。
b)纯度检验如果一化合物在紫外区没有吸收峰,而其杂质有较强吸收,就可方便的检出该化合物中的痕量杂质。例如:要鉴定甲醇和乙醇中的杂质苯,可利用苯在254nm处的B吸收带,而甲醇或乙醇在此波长范围内几乎没有吸收;四氯化碳中有无二硫化碳杂质,只要观察在318nm处有无二硫化碳的吸收峰即可。
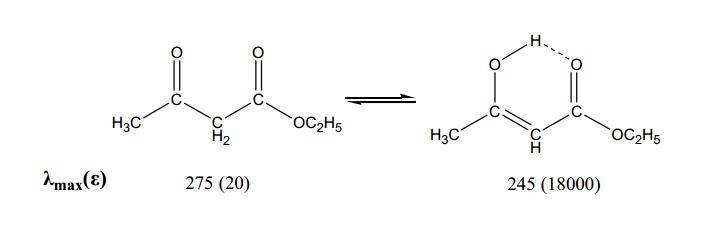
c)异构体的确定有些特殊的极性化合物,在极性或pH不同的溶剂中光谱有很大的变化,表明结构存在某种平衡体系,常见的有互变异构体的平衡和酸碱平衡。乙酰乙酸乙酯、乙酰丙酮等β-二羰基化合物都存在酮式和烯醇式互变异构平衡,在极性溶剂中以酮式为主,两者光谱不同。如乙酰乙酸乙酯在水中显示低强度的R带,在乙烷中,则显示高强度的K带。在极性不同的溶剂中,平衡常数不同。
此外,紫外光谱还可以进行定量分析,可在药物释放方面进行应,对于不含有紫外吸收的聚合物或者药物分子,可以将含有特异吸收峰的分子反应修饰到这些分子上,通过检测修饰分子的UV信号,对聚合物以及小分子进行定性和定量的分析。
小结不同的有机化合物具有不同的吸收光谱,虽然紫外光谱主要用于具有共轭体系的分子,其应用具有一定的局限性,但可用与其它光谱一起相互印证,进行简单的定性分析,用于鉴定共轭发色团,推断未知物骨架,还可以进行定量分析。
科学指南针是杭州研趣信息技术有限公司推出的主品牌,专注科研服务,以分析测试为核心。团队核心成员全部来自美国密歇根大学,卡耐基梅隆大学,瑞典皇家工学院,浙江大学,上海交通大学,同济大学等海内外名校,为您对接测试的项目经理100%具有硕士以上学历。我们整合高校/社会闲置仪器设备资源,甄选优质仪器,为广大科研工作者提供方便、快速、更具性价比的分析测试服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2021-09-10
2021-09-10
 19707
19707
 0
0










