【摘要】 本文系统讲解了胞外囊泡(外泌体、微囊泡、凋亡小体)的详细分类、生物发生途径、特征标志物,并对比分析了差速离心、密度梯度离心、免疫亲和等多种EV分离方法的优劣,最后提供了包括TEM、NTA、WB在内的EV鉴定表征技术指南,为科研工作者提供一站式研究攻略。

文末福利
你可能没听过 “胞外囊泡” 这个名字,但它早已在你的身体里默默工作了几十年 —— 当免疫细胞需要传递敌情、当细胞想清除无用垃圾,甚至当肿瘤细胞悄悄策反健康细胞时,这位直径只有几十到几百纳米的微型快递员,正驮着蛋白、核酸等包裹在细胞间穿梭。

自2010年起,外泌体相关论文数量呈指数级增长,近五年全球年发文量稳定在约5000篇的高位。以中国国家自然科学基金为例,相关项目数从2015年起迅猛增加,2019年达到峰值约600项,此后维持在每年300-400项的水平,证实了该领域的持续火热。

本文将详细讲解:如何从复杂的体液中“抓” 到高纯度的 EV?如何证明EV是EV?无论是科研新手还是行业从业者,都能找到你需要的干货。
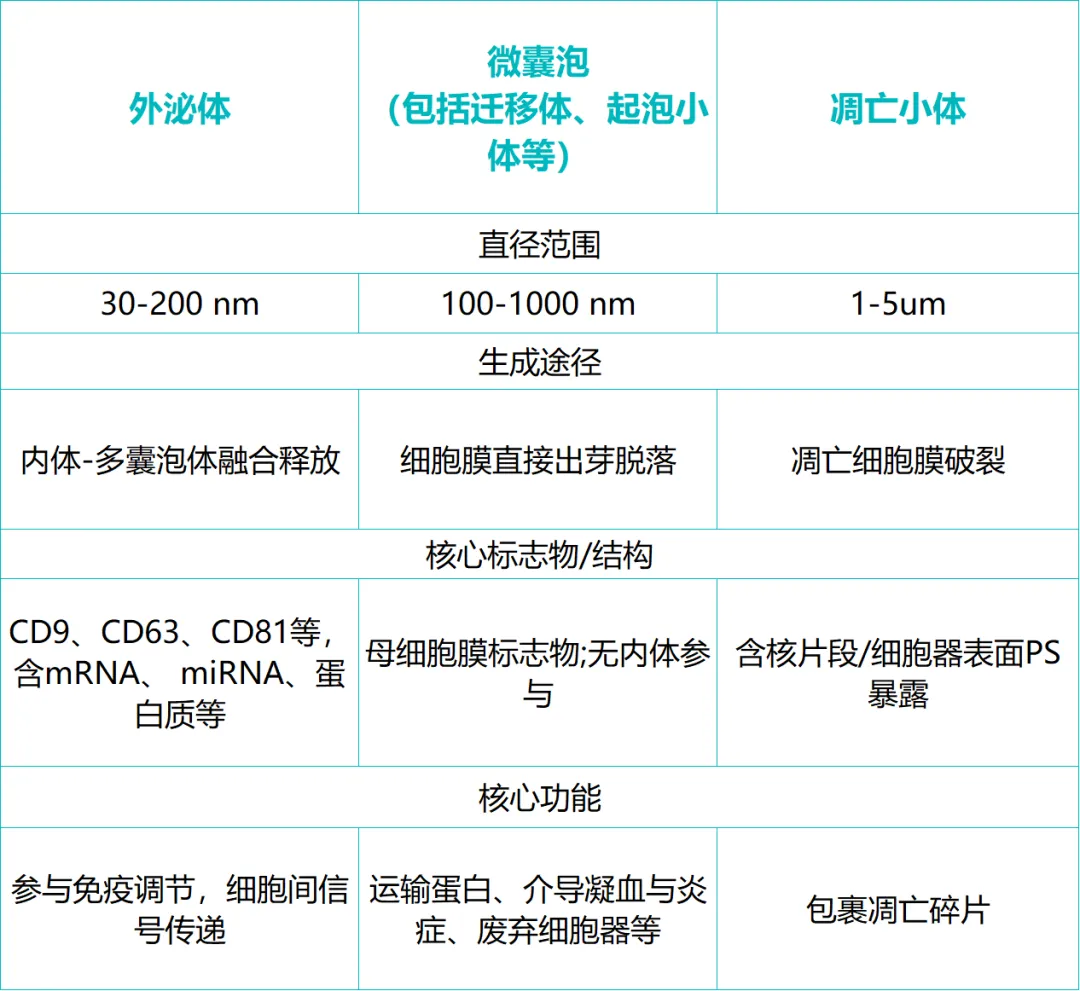
01胞外囊泡的详细分类与特征
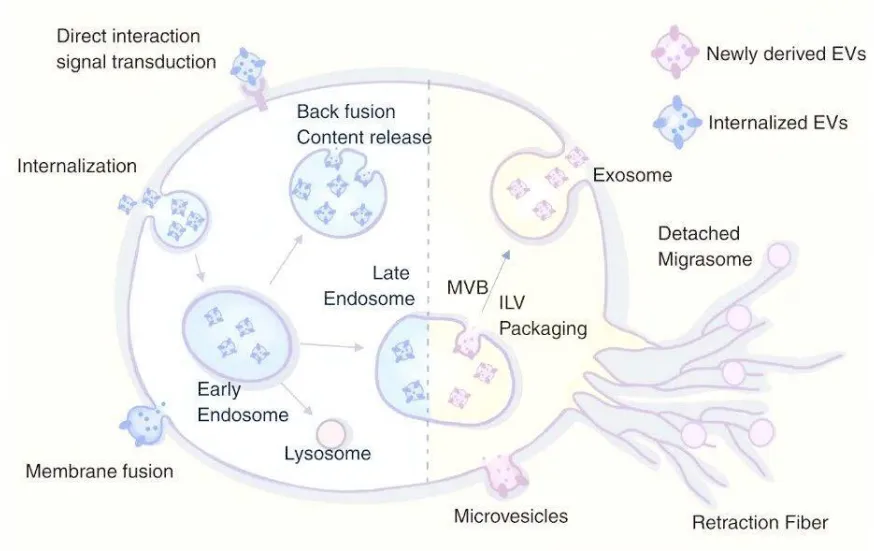
1.外泌体
生物发生途径:详细路径为:细胞膜内陷形成早期内体 → 成熟为晚期内体 → 内膜向内出芽形成多囊泡体 → MVBs与细胞膜融合,将其内部的囊泡(即外泌体)释放到细胞外。
尺寸与形态:直径30-200 nm。在常规TEM制样(干燥)后,因失去水分而塌陷,呈现经典的杯状或茶托状。在冷冻电镜下则保持完美的球形。
标志物:跨膜蛋白CD9、CD63、CD81是常用标志物;腔内蛋白如TSG101、Alix等也是重要鉴定依据。
2.微囊泡
生物发生途径:直接由细胞膜向外出芽、脱落形成。
尺寸与内容:尺寸范围更广(100 nm - 1 μm),内容物与细胞质高度相似,可能包含完整的细胞器(如线粒体碎片)。
3.凋亡小体
来源:细胞程序性死亡过程中,细胞碎裂形成。
特征:尺寸通常较大(1-5 μm),内部包含被随机包裹的细胞器、染色质碎片等。功能主要是被吞噬细胞清除,而非主动通信。
02胞外囊泡的分离与鉴定:方法细节与优劣
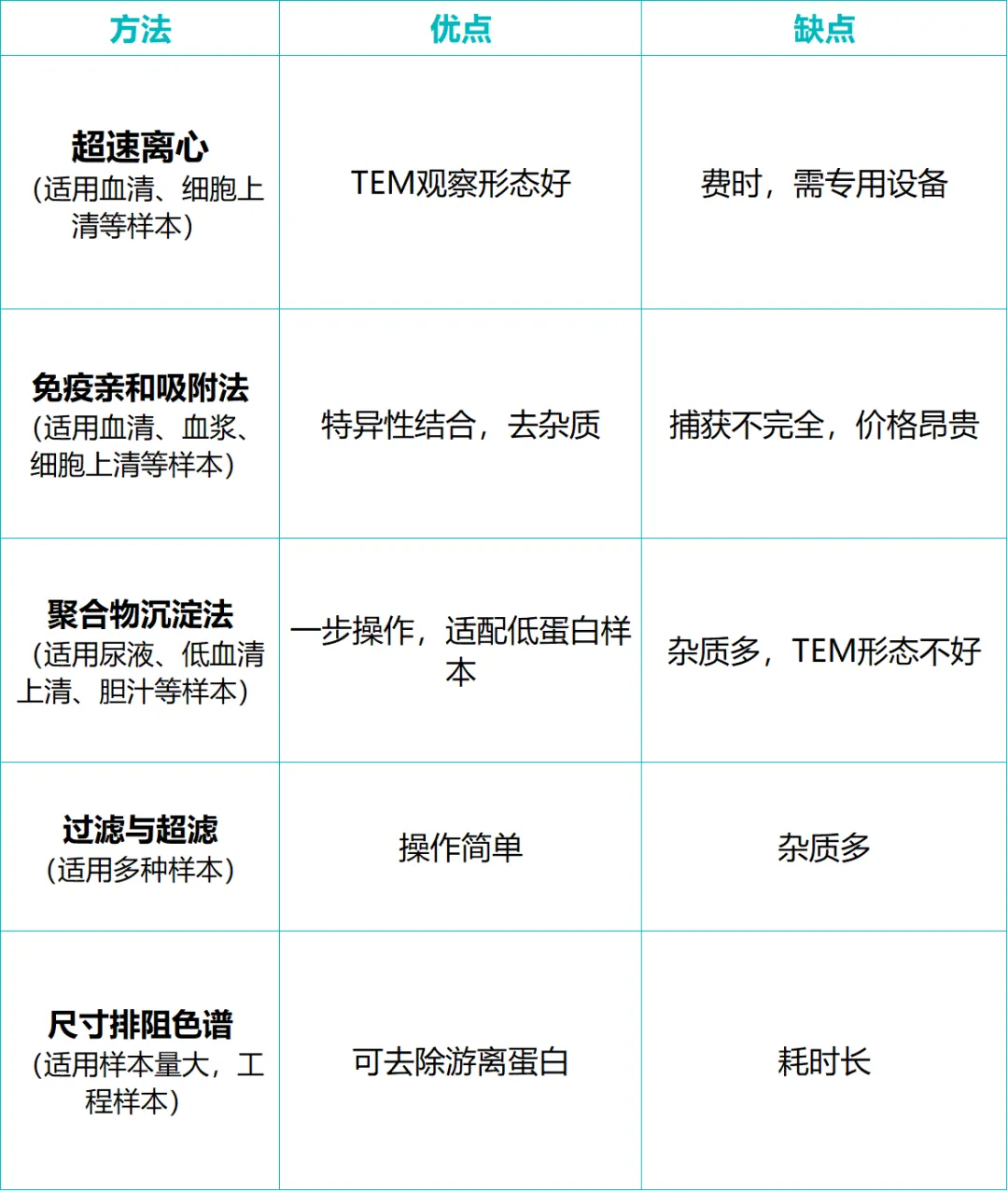
要开展EV 研究,首先需解决 “如何获取高纯度 EV” 的问题,我们首先对主流的分离方法进行详解:
1.差速离心
经典步骤:300-500 g(去除细胞)→ 2,000 g(去除死细胞)→ 10,000 g(去除细胞碎片)→ 100,000 - 120,000 g超速离心70-90分钟(沉淀外泌体)→ PBS重悬洗涤后再离心一次。
缺点是共沉淀杂质多,如蛋白质聚合物、脂蛋白等。
2.蔗糖密度梯度离心
原理:根据颗粒的浮力密度进行分离。外泌体的典型浮力密度范围为1.13 - 1.19 g/mL。
操作:将样品铺在预先制备好的不连续或连续蔗糖梯度液上,超速离心长时间(如10小时以上),外泌体会在与其密度相等的梯度层中富集,从而与大部分杂质(如蛋白质密度<1.25 g/mL,但部分脂蛋白密度与外泌体重叠)分离。是目前能获得最高纯度外泌体的方法之一。
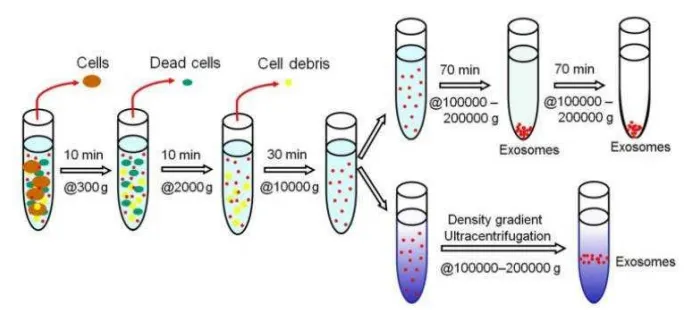
图注:差速离心与密度梯度离心(经典方法)
除此之外,还可以采取免疫亲和吸附,聚合物沉淀,超滤与尺寸排阻色谱以及场流分离、微流控技术等新兴技术做外泌体分离。
那么获取之后,如何确定鉴定捕获了囊泡呢?
首先,形貌表征(TEM)是鉴定膜结构的金标准。能直观看到囊泡是否存在脂质双分子层。
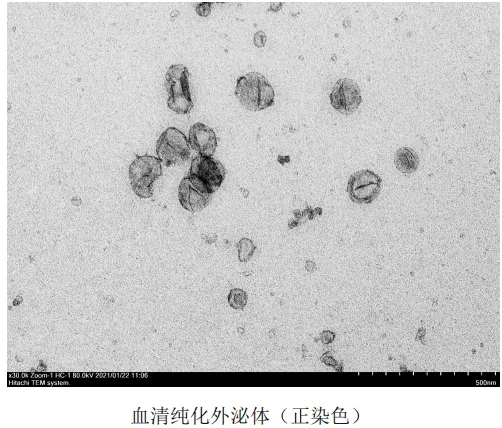
图注:TEM下呈现杯状或茶托状
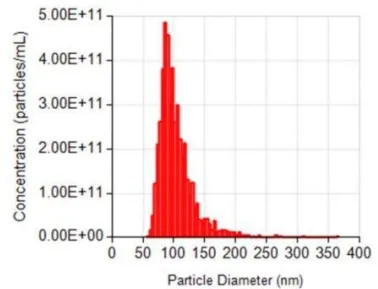
粒径分析即NTA,可以通过跟踪溶液中每个颗粒的布朗运动来计算其粒径和浓度。优势在于能提供颗粒浓度信息(如particles/mL),这是动态光散射所不具备的。
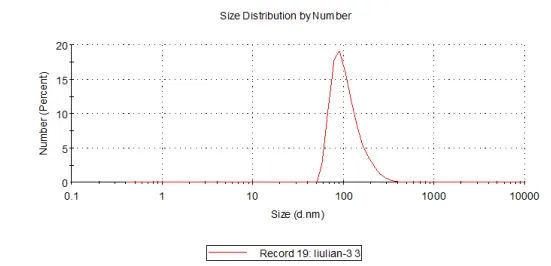
动态光散射即DLS:测量的是整体的散射光强波动,对于多分散样品,其结果易被大颗粒干扰,测得的平均粒径通常比NTA偏大。
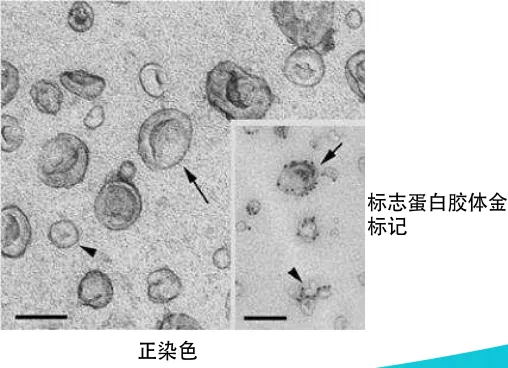
免疫电镜:将TEM与抗体技术结合。例如,用针对CD63的一抗与样品孵育,再用耦联了胶体金颗粒的二抗进行识别,可在电镜下直接观察到金颗粒定位在囊泡表面,从而特异性鉴定其为外泌体。


免费试样
添加客服领福利
生物电镜免费试样











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-12-17
2025-12-17
 899
899
 0
0










