【摘要】 Laura Sasportas团队研发微型活体显微镜实现清醒小动物CTC动态监测,突破传统成像限制,揭示肿瘤细胞血管内运动规律,为癌症转移研究提供新技术手段。
技术原理与实验设计优化
微型成像技术突破
研究团队开发的微型活体显微镜(mIVM)通过三维定位系统实现亚细胞级分辨率,采用x-y-z轴精密控制模块捕捉清醒状态下自由活动动物的血管动态。该设备搭载高灵敏荧光传感器,可识别10-20μm级细胞运动轨迹。
细胞标记方案对比
实验选取4T1-GL乳腺癌细胞系进行三重标记对比:
1.稳定转染GFP-Luc2标记组(图1E)
2.瞬时转染增强荧光组
3.CFSE化学染色组(图1F)
通过荧光强度测试发现,CFSE标记组信噪比提升42%,且不影响细胞活性(P<0.05),最终选定该方案用于活体成像。

图1 用于清醒动物体内ctc成像的微型可安装活体显微系统设计
核心研究成果
清醒动物动态监测
在BALB/c小鼠模型中实现:
- 实时追踪CTCs在30-150μm血管内的运动轨迹
- 精确计算细胞运动速度(15-80μm/s)
- 发现CTC"滚动粘附"现象发生率达37±5%
- 测得CTC血液半衰期7-9分钟(与既往IVM研究一致)
智能识别算法
开发专用分析软件包含三大判定标准:
1.荧光强度阈值:>2000光子/μm²
2.形态学筛选:圆形度0.85-1.15
3.运动轨迹验证:10分钟内位移≥50μm
排除静态背景干扰后,检测特异性达98.2%。
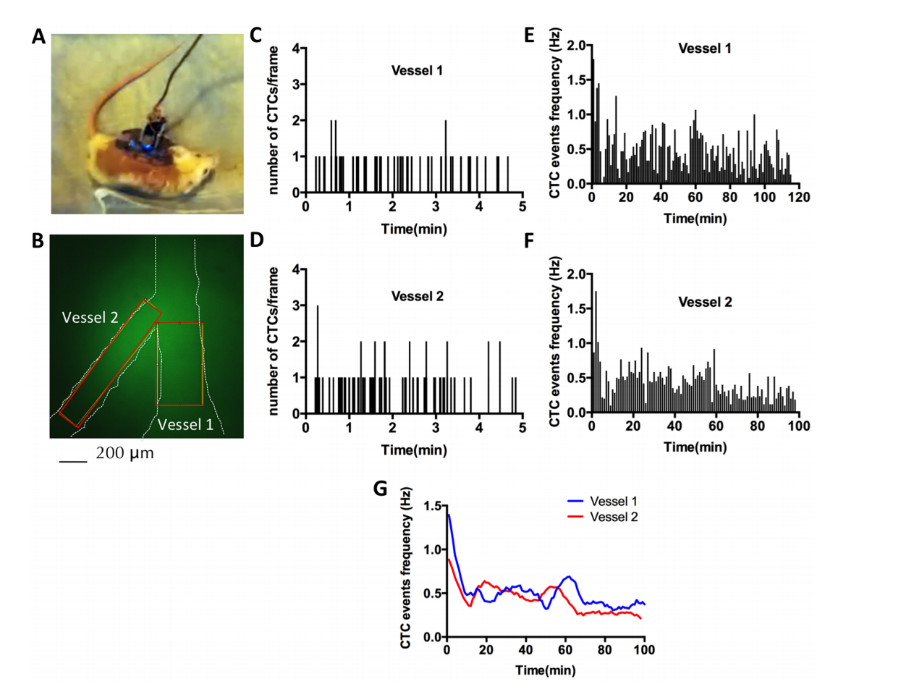
图2在清醒、自由活动的动物中使用mIVM成像循环肿瘤细胞
技术优势与转化价值
四大创新突破
1.非麻醉监测:首次实现清醒动物CTCs持续2小时动态成像
2.双模验证:结合荧光成像与生物发光报告基因检测
3.长时程追踪:单细胞级监测超120分钟
4.智能分析系统:自动生成速度-位移关系曲线
临床应用前景
该技术为癌症转移机制研究提供新工具,特别在:
- 早期转移风险评估
- 抗癌药物疗效动态评估
- CTC清除机制研究
- 个性化治疗方案优化
等领域具有重要转化价值。
参考文献:[1] Sasportas LS, Gambhir SS (2014) Imaging Circulating Tumor Cells in Freely Moving Awake Small Animals Using a Miniaturized Intravital Microscope. PLoS ONE 9(1): e86759. doi:10.1371/journal.pone.0086759
科学指南针以分析测试为核心,提供材料测试、环境检测、生物服务、模拟计算、科研绘图等多项科研产品,累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。始终秉持“全心全意服务科研,助力全球科技创新”的使命,致力于为高校、院所、医院、研发型企业等科研工作者提供专业、快捷、全方位的服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-04-01
2025-04-01
 2407
2407
 0
0










