【摘要】 在过去的二十年里,拉曼光谱已经发展成为生物聚合物研究中最强大的技术之一。
在过去的二十年里,拉曼光谱已经发展成为生物聚合物研究中最强大的技术之一。生物分子(例如蛋白质、核酸或脂质)的拉曼光谱包含许多代表分子正常振动模式的谱带,并作为其结构、组成、相互作用和动力学的敏感和选择性指纹。由于任何病理状态都伴随着受影响组织或细胞中分子组成和/或分子结构的变化,并且这些变化反映在光谱中,因此拉曼光谱作为一种分析工具在医学领域也具有广阔的前景[1]。纯组分及其组装体,例如病毒,已通过拉曼光谱法成功研究[2]。天然生物材料(例如细胞和组织)的分析更为复杂,因为来自数千个分子的光谱贡献重叠,并且当使用可见激光进行激发时,固有荧光通常掩盖较弱的拉曼信号。20世纪80年代末,采用1064 nm Nd-YAG激光激发的近红外(NIR)傅里叶变换(FT)拉曼光谱技术被开发出来,以克服荧光问题[3]。在NIR区域使用激发波长几乎不会导致吸收,从而产生荧光,并可能导致敏感生物材料的激光诱导降解。
显微拉曼光谱(即与显微镜耦合的拉曼光谱)可以成为研究单个细胞的有力方法。它结合了分子特异性和亚微米范围内的衍射极限分辨率,可在无固定剂、标记物或着色剂的体内条件下应用。图1比较了干燥的人骨肉瘤细胞的显微照片(图1A)和拉曼图谱研究的结果(图1B)。数据集是通过使用785 nm二极管激光器进行激发,在1分钟的曝光时间内收集光谱,然后以光栅模式移动样品以绘制定义区域来获得的。原始光谱中的拉曼光谱带被分配给蛋白质、脂质和核酸(图1C)。根据光谱信息,在假彩色图中突出显示主要细胞成分。由于图像对比度反映了样本的分子特性,因此这种方法通常被称为“分 子染色”。图1B中的色码用蓝色表示核区,用红色表示周围富含脂质的细胞器。仪器、分析和培养基中细胞数据的详细信息已在其他地方发布[4]。另一个小组也描述了固定单细胞的类似映射实验[5]。这种方法甚至可以应用于活细胞的研究。最近的研究表明,小鼠肺上皮细胞在785 nm激光功率高达115 mW的长期照射后,其生存能力明显没有受到影响,而在488和514 nm激光照射的细胞中,即使激光功率低至5 mW,其形态也发生了显著变化[6]。通过拉曼光谱对单个细胞的其他研究涉及信号增强方法,例如对单个活红细胞中血红蛋白的研究[7]。这一特殊应用利用了高浓度血红蛋白的存在以及血红蛋白的拉曼信号通过共振效应增强的事实。
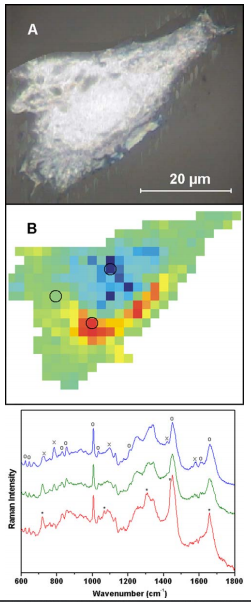
图1 人骨肉瘤细胞的显微照片
参考文献
1.Hanlon EB, Manoharan R, Koo T-W, Shafer KE, Motz JT, Fitzmaurice M, Kramer JR, Itzkan I, Dasari RR, Feld MS (2000) Phys Med Biol 45:R1–R59
2.Thomas GJ (1999) Annu Rev Biophys Biomol Struct 28:1–27
3.Chase B (1987) Anal Chem 58:881A
4.Schrader B (1996) Fresenius J Anal Chem 355:233–239
5.Shim MG, Wilson BC (1997) J Raman Spectrose 28:131–142
6.Krafft C, Knetschke T, Siegner A, Funk RHW, Salzer R (2003) Vib Spectrosc 32:75–83
7.Unzunbajakava N, Lenferink A, Kraan Y, Willekens B, Vrensen G, Greve J, Otto C (2003) Biopolymers 72:1–9
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-03-21
2022-03-21
 5513
5513
 0
0










