【摘要】 分子光谱来源于分子内部不同电子能级、振动能级和转动能级之间的跃迁,转动能级差最小(10-3-10-6eV),振动能级差次之(10-2-1eV),电子能级差最大(1-20eV)。
科学指南针可提供紫外可见吸收光谱测试服务,以下是仪器的相关介绍:
为什么是连续的带状光谱?
分子光谱来源于分子内部不同电子能级、振动能级和转动能级之间的跃迁,转动能级差最小(10-3-10-6eV),振动能级差次之(10-2-1eV),电子能级差最大(1-20eV)。电子光谱的波长在紫外可见区(100-800nm),也称为紫外可见光谱。在发生电子能级跃迁的同时,振动能级和转动能级也不可避免地会发生跃迁,如图1所示。各个能级之间的能量差是非常小的,所以产生的谱线就会非常密集,当仪器分辨率不高的时候,往往会看到一个较宽的带状光谱。如果在惰性溶剂(如饱和烃类等)或者气态中测定,就会看到因振动吸收而产生的锯齿状精细结构。
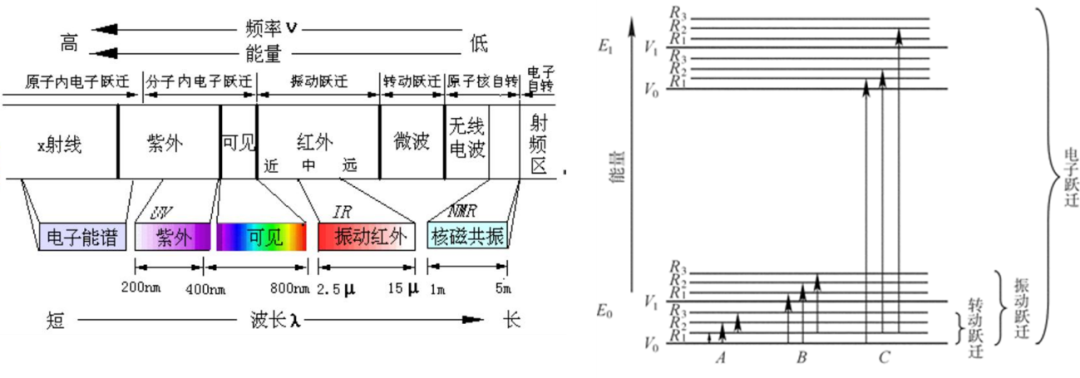
特征吸收峰是如何产生的?
有机化合物分子中涉及三种电子:形成单键的σ电子、形成不饱和键的π电子、未成键的孤对电子(n电子)。处于低能态的成键电子吸收合适的能量后,可以跃迁到一个较高的反键轨道。
如图2:
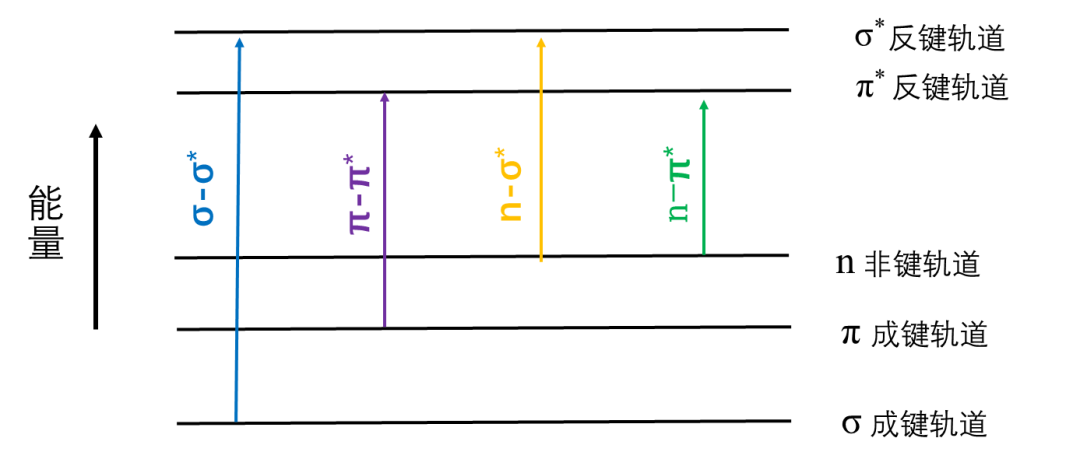
图2:电子跃迁的相对能量示意图
饱和烃分子(甲烷等)只能发生σ-σ*跃迁,σ电子不易激发,所以需要的能量大,需要在波长较短的辐射才能发生,吸收波长<150nm,处于远紫外区。
分子中存在C=C双键时可以发生π-π*跃迁,跃迁所需能量较σ电子小,吸收波长<200nm,如果分子中存在共轭体系,π电子的成键轨道与反键轨道能级差降低,使得π-π*所需的能量减少,因此吸收波长会向长波长移动,随着共轭体系的增长,吸收波长可由近紫外区转向可见光区。例如乙烯的λmax=185nm,而1,3-丁二烯其λmax=217nm。
分子中存在C=O、N=O、N=N等基团,除了可以进行π-π*跃迁外,还可以进行n-π*跃迁,这种跃迁所需能量较少,吸收波长大于200nm。例如丙酮的n-π*跃迁吸收带λmax=279nm,它的π-π*跃迁需要更高的能量,其吸收带λmax≈279nm。
所以紫外谱中特征吸收峰的出现与化合物本身的结构密切相关,这些特征可用于初步对化合物进行分析鉴定。
紫外可见吸收光谱有哪些应用呢?
1.有机化合物结构推测
(1)在210~250nm波长范围内有强吸收峰,则可能含有2个共轭双键;若在260~350nm波长范围内有强吸收峰,则说明该有机物含有3-5个共轭双键。
(2)若在250~300mm波长范围内有中等强度的吸收峰伴有振动精细结构则可能含有苯环。
(3)若在250~300mm波长范围内有低强度吸收峰,且增加溶剂极性会蓝移,则可能含有带孤对电子的未共轭基团,比如羧基。
2.同分异构体的判别
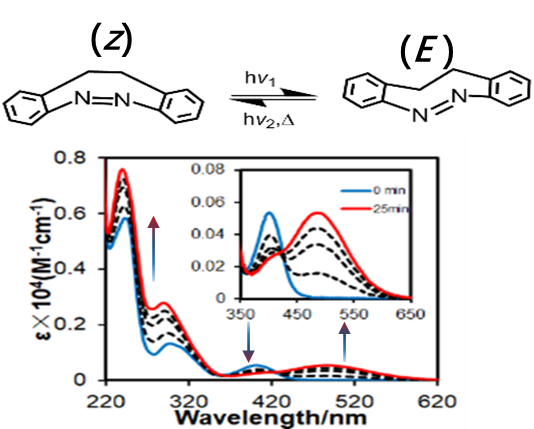
图3:Z –diazocine 和 E –diazocine 的紫外吸收光谱图
如图3,在该偶氮苯系统中, Z 型异构体在热动力学上是更稳定的异构体, 通过蓝光(370–400 nm)照射 Z 型异构体可以转化为 E 型异构体,吸收带会向长波长移动,且异构效率大于 90 %。用绿光(480–550 nm)照射, E型异构体几乎可以定量(100%) 切换回 Z 型异构体。
科学指南针为您提供材料测试,主要业务范围包括XPS,普通XRD,透射电子显微镜TEM,全自动比表面及孔隙度分析BET等测试。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2021-12-31
2021-12-31
 9246
9246
 0
0











